题目内容
13.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )| A. | 生成42.0 L N2(标准状况) | |
| B. | 有0.250 mol KNO3被氧化 | |
| C. | 转移电子的物质的量为2.5 mol | |
| D. | 被氧化的N原子的物质的量为3.75 mol |
分析 10NaN3+2KNO3═K2O+5Na2O+16N2↑中N元素化合价由-$\frac{1}{3}$、+5价变为0价,所以NaN3是还原剂、KNO3是氧化剂,N2既是氧化产物又是还原剂,根据反应方程式可知,每当生成16molN2,则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原;
现氧化产物比还原产物多1.75mol,则生成2molN2,转移电子的物质的量为1.25mol,被氧化的N原子的物质的量为3.75mol,以此解答该题.
解答 解:该反应中N元素化合价由-$\frac{1}{3}$价、+5价变为0价,所以氧化产物和还原产物都是氮气,假设有16mol氮气生成,氧化产物是15mol、还原产物是1mol,则氧化产物比还原产物多14mol,若氧化产物比还原产物多1.75mol,则参加反应的n(KNO3)=$\frac{1.75mol}{14mol}×2$=0.25mol,
A.生成氮气的体积=$\frac{1.75mol}{14mol}×16×22.4L/mol$=44.8 L N2,故A错误;
B.硝酸钾得电子作氧化剂而被还原,故B错误;
C.转移电子的物质的量=3n(KNO3)=5×0.25mol=1.25mol,故C错误;
D.被氧化的N原子的物质的量=$\frac{1.75mol}{14mol}×10×3$=3.75 mol,故D正确;
故选D.
点评 本题考查氧化还原反应有关计算,为高频考点,侧重考查分析计算能力,明确氧化产物和还原产物关系是解本题关键,注意叠氮化钠中N元素化合价,易错选项是B,注意硝酸钾被还原而不是被氧化,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
3.下列说法正确的是( )
| A. | 甲烷和苯都能发生取代反应 | |
| B. | 乙醇和乙酸都能与氢氧化钠发生中和反应 | |
| C. | 乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应 | |
| D. | 淀粉、油脂、蛋白质都属于天然高分子化合物 |
1.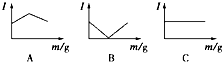 在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.
在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.
以下4个导电性实验,其中与A图B图C图对应一致的选项是( )
①Ba(OH)2溶液中滴入H2SO4溶液至过量②醋酸溶液中滴入NH3•H2O至过量
③澄清石灰水中通入CO2至过量④NH4Cl溶液中逐渐加入适量NaOH固体
 在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.
在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.以下4个导电性实验,其中与A图B图C图对应一致的选项是( )
①Ba(OH)2溶液中滴入H2SO4溶液至过量②醋酸溶液中滴入NH3•H2O至过量
③澄清石灰水中通入CO2至过量④NH4Cl溶液中逐渐加入适量NaOH固体
| A | B | C | |
| A | ① | ② | ③ |
| B | ④ | ②③ | ① |
| C | ③ | ①② | ④ |
| D | ② | ①③ | ④ |
| A. | A | B. | B | C. | C | D. | D |
8.维生素A又称( ) 维生素.
| A. | 视黄醇,水溶性 | B. | 抗坏血酸,水溶性 | C. | 视黄醇,脂溶性 |
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42- | |
| B. | 在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ | |
| C. | 在含有大量Fe3+的溶液中:Cu2+、Cl-、NO3-、S2- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
5.某混合烃由两种气态烃组成,取2.24L该混合烃燃烧后,得到3.36 L CO2和3.6 g水,则下列关于该混合烃的组成判断正确的是(气体体积均在标准状况下测定)( )
| A. | 可能含甲烷 | B. | 可能是甲烷和丙炔的混合气体 | ||
| C. | 一定是甲烷和乙烯的混合气体 | D. | 一定含乙烷 |
2.40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )

| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) | |
| B. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 | |
| D. | 不同pH的溶液中有:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ) |
3.下列各组烃中,所取质量一定时,无论以何样的比例混合,燃烧生成的CO2为一定值的是( )
| A. | 乙烯和环丙烷 | B. | 甲烷和乙烷 | C. | 丙烯和丙烷 | D. | 丙烷和环丙烷 |