题目内容
回收锌锰废电池可生产硫酸锌、碳酸锰等.原料锰粉主要成分为MnO2和碳,含少量锌和铁.焙烧反应之一为:MnO2+C═MnO+CO↑.生产工业级碳酸锰流程如图:
回答下列问题:
(1)第二步用稀H2SO4浸取时需加热,其原因是: .
(2)第三步加入过量酸化的H2O2溶液,其目的是 ,离子方程式为 ;然后将pH调到7.8-8.7(四种离子沉淀的pH范围如右表),其目的是 .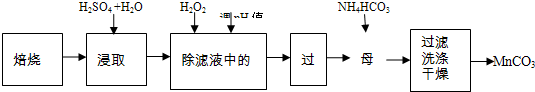
| 化学式 | 开始沉 淀时的 pH值 | 沉淀完 全时的 pH值 |
| Mn(OH)2 | 8.8 | 10.4 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe (OH)3 | 2.7 | 3.7 |
| Zn(OH)2 | 6.4 | 7.8 |
(1)第二步用稀H2SO4浸取时需加热,其原因是:
(2)第三步加入过量酸化的H2O2溶液,其目的是

考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)解热可以加快化学反应速率,据此回答;
(2)双氧水具有氧化性,能将亚铁离子氧化为铁离子,本身的还原产物是水;根据表中物质沉淀的pH数据来判断当pH调到7.8-8.7时,存在的离子以及沉淀的离子.
(2)双氧水具有氧化性,能将亚铁离子氧化为铁离子,本身的还原产物是水;根据表中物质沉淀的pH数据来判断当pH调到7.8-8.7时,存在的离子以及沉淀的离子.
解答:
解:MnO2和碳以及少量锌和铁在焙烧时的反应为:MnO2+C
MnO+CO↑,向焙烧后的产物中加入硫酸,可以得到硫酸锰、硫酸亚铁以及硫酸锌的混合液,向混合液中加入双氧水,可以将亚铁离子氧化为铁离子,调节pH到合适的范围,可以将铁离子、锌离子沉淀下来,留下锰离子,即得到硫酸锰的水溶液,向其中加入碳酸氢铵溶液,可以发生反应得到碳酸锰沉淀,过滤洗涤即可得到碳酸锰的固体.
(1)第二步用稀H2SO4浸取时需加热,这样可以增大浸出速率,提高单位时间浸出物的产率,故答案为:增大浸出速率,提高单位时间浸出物的产率;
(2)第三步向硫酸锰、硫酸亚铁以及硫酸锌的混合液中加入双氧水,可以将亚铁离子氧化为铁离子:2Fe2++H2O2+4H+═2Fe3++2H2O,然后根据四种离子沉淀的pH范围表,将pH调到7.8-8.7,可以使Fe3+、Zn2+沉淀完全,溶液中只留下Mn2+;
故答案为:将Fe2+氧化为Fe3+;2Fe2++H2O2+4H+═2Fe3++2H2O;使Fe3+、Zn2+沉淀完全,溶液中只留下Mn2+.
| ||
(1)第二步用稀H2SO4浸取时需加热,这样可以增大浸出速率,提高单位时间浸出物的产率,故答案为:增大浸出速率,提高单位时间浸出物的产率;
(2)第三步向硫酸锰、硫酸亚铁以及硫酸锌的混合液中加入双氧水,可以将亚铁离子氧化为铁离子:2Fe2++H2O2+4H+═2Fe3++2H2O,然后根据四种离子沉淀的pH范围表,将pH调到7.8-8.7,可以使Fe3+、Zn2+沉淀完全,溶液中只留下Mn2+;
故答案为:将Fe2+氧化为Fe3+;2Fe2++H2O2+4H+═2Fe3++2H2O;使Fe3+、Zn2+沉淀完全,溶液中只留下Mn2+.
点评:本题考查了物质制备方案的设计流程分析判断,离子性质和检验的应用调节溶液PH除去杂质离子是解题关键,题目难度中等.

练习册系列答案
相关题目
下列物质的转化在给定条件下能实现的是( )
①Na
Na2O
Na2O2
②CaCO3
CO2
C
③NaCl(饱和)
NaHCO3
Na2CO3
④Fe
FeCl2
FeCl3.
①Na
| 氧气 |
| 点燃 |
| 氧气 |
| 点燃 |
②CaCO3
| 稀硫酸 |
| Mg |
| 点燃 |
③NaCl(饱和)
| NH3、CO2 |
| △ |
④Fe
| 氯气 |
| 点燃 |
| 氯气 |
| 点燃 |
| A、①④ | B、②③ | C、③ | D、④ |
下列鉴别物质的方法能达到实验目的是( )
| A、用澄清石灰水鉴别CO2和SO2 |
| B、用丁达尔效应鉴别淀粉溶液和氢氧化铝胶体 |
| C、用焰色反应鉴别KCl和NaNO3 |
| D、用NaOH溶液鉴别FeCl3溶液和Fe(SO4)3溶液 |
在密闭容器中发生下列反应aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,C的浓度为原平衡的1.6倍,下列叙述正确的是( )
| A、A的转化率变大 |
| B、平衡向正反应方向移动 |
| C、D的质量分数变大 |
| D、a<c+d |

 加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.(忽略溶液体积变化)
加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.(忽略溶液体积变化)