题目内容
9.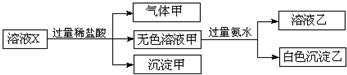 水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图实验:下列判断正确的是( )
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图实验:下列判断正确的是( )| A. | 沉淀甲不一定是纯净物 | |
| B. | 溶液中一定有Al3+和CO32-和SiO32- | |
| C. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| D. | CO32-和SO42-一定不存在于溶液X中 |
分析 溶液X中进入过量盐酸,生成的气体甲,气体甲可能为二氧化硫或者二氧化碳,原溶液中可能存在SO32-、CO32-,溶液中一定不存在Mg2+、Al3+,再根据溶液电中性可知,原溶液中一定存在唯一的阳离子K+;
加入盐酸生成了沉淀甲,根据题干的离子可知,溶液中一定存在SiO32-,沉淀甲为硅酸;
无色溶液甲中加入过量氨水,得到的白色沉淀,说明原溶液中一定存在AlO2-,白色沉淀乙为氢氧化铝,以此解答该题.
解答 解:溶液X中进入过量盐酸,生成的气体甲,气体甲可能为二氧化硫或者二氧化碳,原溶液中可能存在SO32-、CO32-,溶液中一定不存在Mg2+、Al3+,再根据溶液电中性可知,原溶液中一定存在唯一的阳离子K+;
加入盐酸生成了沉淀甲,根据题干的离子可知,溶液中一定存在SiO32-,沉淀甲为硅酸;
无色溶液甲中加入过量氨水,得到的白色沉淀,说明原溶液中一定存在AlO2-,白色沉淀乙为氢氧化铝,
A.沉淀甲为硅酸,为纯净物,故A错误;
B.Al3+和CO32-、SiO32-发生互促水解反应,不能大量共存,故B错误;
C.根据以上分析可知,原溶液中一定存在K+、AlO2-和SiO32-,故C正确;
D.硫酸根离子是否存在不能确定,CO32-可能存在,故D错误.
故选C.
点评 本题考查了无机物的推断,侧重考查离子共存、常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,要求学生能够根据反应现象判断离子存在情况,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是S2->O2->Na+(填离子符号)
(2)A、B、C、D的任意三种元素可组成多种化合物,X和Y是其中的两种;X和Y都是既含离子键又含有共价键的离子化合物:将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的PH<7,Y水溶液PH>7.将0.2mol/L的X溶液与0.1mol/L的Y溶液等体积混合后,溶液呈碱性.请判断:
①X的化学式为NH4NO3,Y的化学式为NaOH
②混合溶液中各种带电微粒的物质的量的浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(Na+ )>c(OH-)>c(H+)
(3)A、C两元素的单质与熔融K2CO3组成的燃料电池,其负极反应式为H2+CO32--2e-=CO2↑+H2O用该电池电解1L 1mol/L NaCl溶液,当消耗标准状况下1.12L A2时,NaCl溶液的PH=13(假设电解过程中溶液的体积不变).
(4)25℃,两种酸的电离平衡常数如下表:
请写出H2SO3溶液和NaHCO3溶液反应的主要离子方程式H2SO3+HCO3-=HSO3-+H2O+CO2↑
(5)常温下0.2mol/L的H2C2O4溶液的PH为2.1.H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫红色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成Mn2+对反应起到催化作用(忽略反应的热效应)
请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是S2->O2->Na+(填离子符号)
(2)A、B、C、D的任意三种元素可组成多种化合物,X和Y是其中的两种;X和Y都是既含离子键又含有共价键的离子化合物:将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的PH<7,Y水溶液PH>7.将0.2mol/L的X溶液与0.1mol/L的Y溶液等体积混合后,溶液呈碱性.请判断:
①X的化学式为NH4NO3,Y的化学式为NaOH
②混合溶液中各种带电微粒的物质的量的浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(Na+ )>c(OH-)>c(H+)
(3)A、C两元素的单质与熔融K2CO3组成的燃料电池,其负极反应式为H2+CO32--2e-=CO2↑+H2O用该电池电解1L 1mol/L NaCl溶液,当消耗标准状况下1.12L A2时,NaCl溶液的PH=13(假设电解过程中溶液的体积不变).
(4)25℃,两种酸的电离平衡常数如下表:
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(5)常温下0.2mol/L的H2C2O4溶液的PH为2.1.H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫红色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成Mn2+对反应起到催化作用(忽略反应的热效应)
20.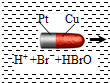 一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )
一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )
 一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )
一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )| A. | 铜为电池的正极 | |
| B. | 铂不断溶解 | |
| C. | 稀溴水为电解质溶液 | |
| D. | 电池工作时实现机械能向电能再向化学能转化 |
17.下列物质中最简式相同,但既不是同系物,也不是同分异构体的是( )
| A. | CH3CH═CH2和 | B. | 乙炔和苯 | C. |  和 和 | D. | 苯和苯酚 |
4.下列有关物质的性质或应用的说法正确的是( )
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 等质量的乙烷、乙烯、乙炔在氧气中完全燃烧,乙烷消耗的氧气最多 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
14.下列混合物的分离和提纯方法中,主要是从溶解性角度考虑的是( )
①过滤 ②蒸发 ③蒸馏 ④萃取.
①过滤 ②蒸发 ③蒸馏 ④萃取.
| A. | ①② | B. | ①④ | C. | ③④ | D. | ②③ |
1.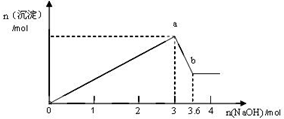 现有FeCl3、AlCl3的混合溶液250mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图所示,则混合液中FeCl3的物质的量浓度是( )
现有FeCl3、AlCl3的混合溶液250mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图所示,则混合液中FeCl3的物质的量浓度是( )
 现有FeCl3、AlCl3的混合溶液250mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图所示,则混合液中FeCl3的物质的量浓度是( )
现有FeCl3、AlCl3的混合溶液250mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图所示,则混合液中FeCl3的物质的量浓度是( )| A. | 0.4 mol/L | B. | 1.8 mol/L | C. | 1.6 mol/L | D. | 1.2 mol/L |
18.用作麻醉剂的氯仿(CHCl3)常因保存不慎而被空气氧化,产生剧毒的光气(COCl2),反应的化学方程式为2CHCl3+O2═2HCl+2COCl2.为了防止事故,使用前可用于检验氯仿是否变质的试剂是(注:CHCl3不与AgNO3溶液反应产生沉淀)( )
| A. | 酚酞试液 | B. | 用石蕊溶液 | ||
| C. | NaOH溶液 | D. | 用硝酸酸化后的Ba(NO3)2溶液 |
19.下列酸在与金属发生反应时,有氢气产生的是( )
| A. | 稀硫酸 | B. | 稀硝酸 | C. | 浓硫酸 | D. | 浓硝酸 |