题目内容
10.A、B、C、D为短周期主族元素,A的M电子层有1个电子,B的最外层电子数为内层电子数的2倍,C2-离子结构与Ne电子层结构相同,C与D主族.(1)B位于元素周期表第二周期第IVA族.
(2)C元素原子结构示意图为
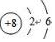 .A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)
.A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)(3)用电子式表示A2 D形成过程
 _.
_.(4)A、D元素最高价氧化物对应水化物相互反应的化学方程式为H++OH-=H2O.
分析 A、B、C、D为短周期主族元素,A的M电子层有1个电子,则A位于第三周期ⅠA族,为Na元素;B的最外层电子数为内层电子数的2倍,原子最外层最多容纳8个电子,则B含有两个电子层,最外层含有4个电子,为C元素;C2-离子结构与Ne电子层结构相同,则C为O元素;C与D主族,且都是短周期元素,则D为S元素,据此进行解答.
解答 解:A、B、C、D为短周期主族元素,A的M电子层有1个电子,则A位于第三周期ⅠA族,为Na元素;B的最外层电子数为内层电子数的2倍,原子最外层最多容纳8个电子,则B含有两个电子层,最外层含有4个电子,为C元素;C2-离子结构与Ne电子层结构相同,则C为O元素;C与D主族,且都是短周期元素,则D为S元素,
(1)B为C元素,其原子序数为6,位于周期表中第二周期IVA族,
故答案为:二;IVA;
(2)C为O元素,其核电荷数=核外电子总数=8,其原子结构示意图为: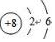 ;
;
A+、C2-、D-分别为Na+、O2-、S2-,离子的电子层越多,离子半径越大,电子层相同时离子的核电荷数越大,离子半径越小,则离子半径最小的是Na+,
故答案为: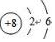 ;Na+;
;Na+;
(3)A2D为Na2S,Na2S为离子化合物,一个钠原子失去一个电子,一个硫原子得到两个电子,则用电子式表示Na2S的形成过程为: ,
,
故答案为: ;
;
(4)A、D元素最高价氧化物对应水化物分别为NaOH、硫酸,二者反应生成硫酸钠和水,反应的化学方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,根据题干信息正确推断元素为解答关键,注意掌握常见化学用语的概念及表示方法,试题有利于提高学生的分析能力及逻辑推理能力.

练习册系列答案
相关题目
1.在标准状况下,将28L HCl气体溶液在水中配成250mL盐酸溶液
(1)求所得盐酸的物质的量浓度5mol/L
(2)若取此溶液50mL再稀释成1L溶液,求稀释后盐酸的物质的量浓度0.25mol/L.
(1)求所得盐酸的物质的量浓度5mol/L
(2)若取此溶液50mL再稀释成1L溶液,求稀释后盐酸的物质的量浓度0.25mol/L.
18.在给定条件下,下列选项所示的物质间转化均能实现的是( )
| A. | S$\stackrel{O_{2}、点燃}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | H2SO4$\stackrel{Cu}{→}$SO2$\stackrel{BaCl_{2}溶液}{→}$BaSO3 | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | SiO2$\stackrel{NaOH}{→}$Na2SiO3$\stackrel{HCl}{→}$H2SiO3 |
5.下列说法正确的是( )
| A. | c(H+)=$\sqrt{{K}_{W}}$的溶液一定呈中性 | |
| B. | 金属钠、镁着火时可用泡沫灭火器扑灭 | |
| C. | 用玻璃棒蘸取待测液于湿润的pH试纸上测pH 值 | |
| D. | 常温下1L PH=13的Ba(OH)2溶液中含有0.2NA个OH- 离子 |
15.下列离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=[Al(OH)4]-+4 NH4+ | |
| B. | 澄清石灰水与小苏打溶液混合:Ca2++CO32-=CaCO3↓ | |
| C. | Na[Al(OH)4]溶液中加入过量盐酸:AlO2-+H++H2O=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
2.下列化学用语正确的是( )
| A. | 甲烷分子的球棍模型  | B. | 醛基的电子式  | ||
| C. | 乙酸的结构简式 C2H4O2 | D. | 乙烯的最简式为 CH2 |
8.已知:CuS、Cu2S是两种黑色不溶于水的固体,但一定条件下都能与稀HNO3反应,用离子方程式表示为:
①3CuS+8H++8NO3-=3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-=6Cu2++3SO42-+10NO↑+8H2O
现有不同质量的四份CuS、Cu2S的混合物样品分别和100mL物质的量浓度5mol/L稀硝酸充分反应,所取样品质量与产生气体体积(标准状况下测定)如表所示:
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
(1)a组实验结束后,溶液中c(NO3-)=2.75mol/L;
(2)b组实验结束后,溶液的pH=0;
(3)通过计算分析实验c组中产生气体的体积(V)范围7L<V<11.2L.
①3CuS+8H++8NO3-=3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-=6Cu2++3SO42-+10NO↑+8H2O
现有不同质量的四份CuS、Cu2S的混合物样品分别和100mL物质的量浓度5mol/L稀硝酸充分反应,所取样品质量与产生气体体积(标准状况下测定)如表所示:
| 实验序号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
(1)a组实验结束后,溶液中c(NO3-)=2.75mol/L;
(2)b组实验结束后,溶液的pH=0;
(3)通过计算分析实验c组中产生气体的体积(V)范围7L<V<11.2L.
 .若此烷烃的一氯代物分子中含有两个-CH3,两个-CH2-,一个
.若此烷烃的一氯代物分子中含有两个-CH3,两个-CH2-,一个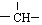 和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.
和一个-Cl,它的可能结构有四种,请写出它们的结构简式:CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3、CH3CH(CH3)CH2CH2Cl、CH2ClCH(CH3)CH2CH3.