题目内容
13.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 标准状况下,22.4L的CCl4中含有CCl4分子数目为NA | |
| C. | 25℃时,1L 1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| D. | 6.4gCu与一定浓度的HNO3完全反应得到混合气体,转移的电子数目为0.2NA |
分析 A.溶液体积未知;
B.气体摩尔体积使用对象为气体;
C.次氯酸根离子水溶液中部分水解;
D.铜与硝酸反应生成硝酸铜,依据铜的物质的量计算转移电子数.
解答 解:A.依据n=CV可知,溶液体积未知,无法计算氢氧根离子数目,故A错误;
B.标况下四氯化碳为液体,不能使用气体摩尔体积,故B错误;
C.次氯酸根离子水溶液中部分水解,所以25℃时,1L 1mol•L-1的NaClO溶液中含有ClO-的数目小于NA,故C错误;
D.6.4gCu物质的量为:$\frac{6.4g}{64g/mol}$=0.1mol,与一定浓度的HNO3完全反应得到混合气体,生成0.1mol铜离子,转移的电子数目为0.2NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.

练习册系列答案
相关题目
16.下列关于苯酚的叙述中,正确的是( )
| A. | 呈弱酸性,使石蕊试液显浅红色 | |
| B. | 分子中的13个原子有可能处于同一平面 | |
| C. | 可以和NaHCO3溶液反应产生气体 | |
| D. | 能与FeCl3溶液反应生成紫色沉淀 |
4.下列物质不属于硅酸盐产品的是( )
| A. | 青花瓷 | B. | 水泥 | C. | 石英 | D. | 玻璃 |
1.设NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 20 g氖气所含原子数约为6.02×1023 | |
| C. | 标准状况下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
18. 如图是温度和压强对X+Y?2Z反应影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
如图是温度和压强对X+Y?2Z反应影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
 如图是温度和压强对X+Y?2Z反应影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
如图是温度和压强对X+Y?2Z反应影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )| A. | 上述可逆反应的正反应为放热反应 | B. | X、Y、Z均为气态 | ||
| C. | X和Y中只有一种为气态,Z为气态 | D. | X和Y均为非气体 |
5.化学实验设计和操作中必须十分重视安全和环境.下列实验问题处理方法正确的是( )
| A. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| B. | 在气体发生装置上直接点燃一氧化碳气体时,必须要先检验一氧化碳气体的纯度.最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声 | |
| C. | 制氧气时排水法收集氧气后出现倒吸现象,应立即松开试管上的橡皮塞 | |
| D. | 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
2.下列关于烷烃性质的叙述中,不正确的是( )
| A. | 烷烃同系物随着相对分子质量增大,熔点、沸点逐渐升高 | |
| B. | 烷烃都能使溴水、酸性KMnO4溶液褪色 | |
| C. | 烷烃跟卤素单质在光照条件下能发生取代反应 | |
| D. | 烷烃同系物的密度随着相对分子质量的增大逐渐增大 |
3.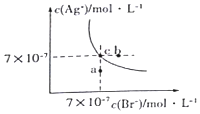 在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )
 在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 图中a点对应的是AgBr的不饱和溶液 | |
| B. | 在t°C时,AgBr的Ksp为 4.9×10-13 | |
| C. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 | |
| D. | 在t°C时,AgCl(s)+Br-(aq)?AgBr(s)+C1-(aq)的平衡常数K≈816 |