题目内容
有某二价金属氧化物和某三价金属氧化物的等物质的量组成的混合物,两者质量比为28:51,取这种混合物19.75g,恰好能与166mL 质量分数为20%、密度为1.10g/cm3的盐酸反应.试求这两种金属的相对原子质量.
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:根据c=
计算盐酸的物质的量浓度,再根据n=cV计算HCl的物质的量.令氧化物化学式为RO、M2O3,二者物质的量相等,设它们的物质的量都是xmol,恰好反应后得到金属氯化物,根据原子守恒守列方程算二者物质的量,根据质量之比计算各自质量,再根据M=
确定RO、M2O3的摩尔质量,进而确定金属的相对原子质量.
| 1000ρw |
| M |
| M |
| n |
解答:
解:质量分数为20%、密度为1.10g/cm3的盐酸的物质的量浓度=
mol/L=6.03mol/L,166mL该盐酸溶液中HCl的物质的量=6.03mol/L×0.166L≈1mol,
令氧化物化学式为RO、M2O3,二者物质的量相等,设它们的物质的量都是xmol,恰好反应后得到金属氯化物RCl2、MCl3,根据R、M、Cl原子守恒可知:2x+3×2x=1,解得x=0.125mol,
混合物19.75g,RO、M2O3的质量比为28:51,则RO的质量=19.75g×
=7g,其摩尔质量=
=56g/mol,故金属R的相对原子质量=56-16=40,
M2O3的质量=19.75-7g=12.75g,其摩尔质量=
=102g/mol,故金属M的相对原子质量=
=27,
答:二价金属的相对原子质量为40,三价金属的相对原子质量为27.
| 1000×1.1×20% |
| 36.5 |
令氧化物化学式为RO、M2O3,二者物质的量相等,设它们的物质的量都是xmol,恰好反应后得到金属氯化物RCl2、MCl3,根据R、M、Cl原子守恒可知:2x+3×2x=1,解得x=0.125mol,
混合物19.75g,RO、M2O3的质量比为28:51,则RO的质量=19.75g×
| 28 |
| 28+51 |
| 7g |
| 0.125mol |
M2O3的质量=19.75-7g=12.75g,其摩尔质量=
| 12.75g |
| 0.125mol |
| 102-16×3 |
| 2 |
答:二价金属的相对原子质量为40,三价金属的相对原子质量为27.
点评:本题考查物质的量浓度计算、根据方程式计算等,难度不大,根据消耗盐酸计算金属氧化物的物质的量是根据,注意利用守恒思想进行计算,可以根据方程式计算,相对原子守恒而言比较麻烦.

练习册系列答案
相关题目
根据原子结构及元素周期律的知识,下列推断正确的是( )
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| B、核外电子排布相同的微粒化学性质也相同 | ||||
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 | ||||
D、
|
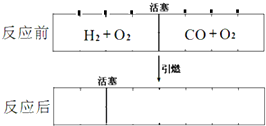 在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况,反应前后活塞位置如图所示,则右侧混合气体中一氧化碳和氧气的物质的量之比可能是(液态水的体积忽略不计)
在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况,反应前后活塞位置如图所示,则右侧混合气体中一氧化碳和氧气的物质的量之比可能是(液态水的体积忽略不计)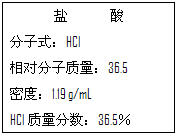 如图为实验室某浓盐酸试剂瓶标签上的有关数据,请根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,请根据标签上的有关数据回答下列问题: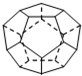 (1)德国和美国科学家首先制出由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成 (如图所示).请回答:C20分子共有
(1)德国和美国科学家首先制出由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成 (如图所示).请回答:C20分子共有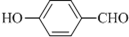 的沸点比
的沸点比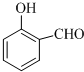 高,其原因是
高,其原因是