题目内容
4. 工业合成氨反应为:N2(g)+3H2(g) $?_{高温高压}^{催化剂}$ 2NH3(g),对其研究如下:
工业合成氨反应为:N2(g)+3H2(g) $?_{高温高压}^{催化剂}$ 2NH3(g),对其研究如下:(1)已知H-H键能为436kJ•mol-1,N-H键能为391kJ•mol-1,N≡N键的键能是945.6kJ•mol-1,则上述反应的△H=-92.46kJ•mol-1.
(2)上述反应的平衡常数K的表达式为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.若反应方程式改写为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),在该温度下的平衡常数:K1=$\sqrt{K}$(用K表示).
(3)在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
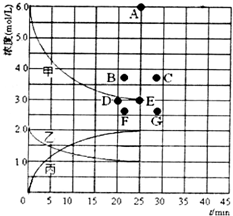
②由上述表中的实验数据计算得到“浓度~时间”的关系可用如图的曲线表示,表示 c(N2)~t的曲线是乙.在此温度下,若起始充入4molN2和12molH2,反应刚达到平衡时,表示c(H2)的曲线上相应的点为B.
分析 (1)根据反应热=反应物的总键能-生成物的总键能,据此计算;
(2)K为生成物浓度幂之积与反应物浓度幂之积的比,化学计量数为倍数关系,而K为指数关系;
(3)①由表可知表可知25min反应达平衡状态,
N2(g)+3H2(g)?2NH3(g),
初起(mol/L):2 6 0
变化(mol/L):1 3 2
平衡(mol/L):1 3 2
此时平衡常数为:K=$\frac{{2}^{2}}{{3}^{3}×1}$=$\frac{4}{27}$,根据Qc与K的大小平衡判断正逆反应速率的大小;
②由反应方程式可知:N2(g)+3H2(g)?2NH3(g)变化量之比等于对应物质的化学计量数之比,而△n甲:△n乙:△n丙=3:1:2,所以表示c(N2)~t的曲线是乙;在此温度下,若起始充入4molN2和12molH2,相当于在原来基础上增加压强,平衡正向移动,所以比原平衡的两倍小,而且达平衡的时间缩短,由此分析解答.
解答 解:(1)已知:H-H键能为436kJ•mol-1,H-N键能为391kJ•mol-1,N≡N键的键能945.6kJ•mol-1,对于反应N2(g)+3H2(g)=2NH3(g)的反应热=反应物的总键能-生成物的总键能=945.6kJ•mol-1+436kJ•mol-1×2-391kJ•mol-1×6=-92.46kJ•mol-1,
故答案为:-92.46kJ•mol-1;
(2)N2(g)+3H2(g) $?_{高温高压}^{催化剂}$ 2NH3(g)的K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),在该温度下的平衡常数:K1=$\sqrt{K}$,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$;$\sqrt{K}$;
(3)①由表可知表可知25min反应达平衡状态,
N2(g)+3H2(g)?2NH3(g),
初起(mol/L):2 6 0
变化(mol/L):1 3 2
平衡(mol/L):1 3 2
此时平衡常数为:K=$\frac{{2}^{2}}{{3}^{3}×1}$=$\frac{4}{27}$,根据Qc=$\frac{{3}^{2}}{{3}^{3}×3}$=$\frac{3}{27}$<K,所以平衡正向移动,即此时v正大于v逆,
故答案为:大于;
②由反应方程式可知:N2(g)+3H2(g)?2NH3(g)变化量之比等于对应物质的化学计量数之比,而△n甲:△n乙:△n丙=3:1:2,所以表示c(N2)~t的曲线是乙;在此温度下,若起始充入4molN2和12molH2,相当于在原来基础上增加压强,平衡正向移动,所以比原平衡的两倍小,而且达平衡的时间缩短,则应是点B,
故答案为:乙;B.
点评 本题考查化学平衡的计算,为高频考点,把握图象及表格数据的应用、平衡三段法、K与Qc的计算为解答的关键,侧重分析与计算能力的考查,注意焓变计算方法、平衡移动原理的应用,题目难度不大.

| A. | 4.68 g | B. | 6..68 g | ||
| C. | 2.34 g | D. | 由于m未知,无法计算 |



 天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.