题目内容
已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的( )
A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因该反应为放热反应,故不必加热就可发生
练习册系列答案
相关题目
4. 工业合成氨反应为:N2(g)+3H2(g) $?_{高温高压}^{催化剂}$ 2NH3(g),对其研究如下:
工业合成氨反应为:N2(g)+3H2(g) $?_{高温高压}^{催化剂}$ 2NH3(g),对其研究如下:
(1)已知H-H键能为436kJ•mol-1,N-H键能为391kJ•mol-1,N≡N键的键能是945.6kJ•mol-1,则上述反应的△H=-92.46kJ•mol-1.
(2)上述反应的平衡常数K的表达式为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.若反应方程式改写为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),在该温度下的平衡常数:K1=$\sqrt{K}$(用K表示).
(3)在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
①该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度分别为3mol/L,3mol/L、3mol/L,此时v正大于v逆(填“大于”、“小于”或“等于”)
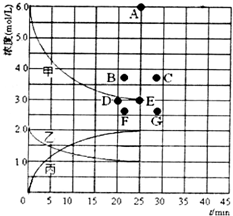
②由上述表中的实验数据计算得到“浓度~时间”的关系可用如图的曲线表示,表示 c(N2)~t的曲线是乙.在此温度下,若起始充入4molN2和12molH2,反应刚达到平衡时,表示c(H2)的曲线上相应的点为B.
 工业合成氨反应为:N2(g)+3H2(g) $?_{高温高压}^{催化剂}$ 2NH3(g),对其研究如下:
工业合成氨反应为:N2(g)+3H2(g) $?_{高温高压}^{催化剂}$ 2NH3(g),对其研究如下:(1)已知H-H键能为436kJ•mol-1,N-H键能为391kJ•mol-1,N≡N键的键能是945.6kJ•mol-1,则上述反应的△H=-92.46kJ•mol-1.
(2)上述反应的平衡常数K的表达式为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.若反应方程式改写为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),在该温度下的平衡常数:K1=$\sqrt{K}$(用K表示).
(3)在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
②由上述表中的实验数据计算得到“浓度~时间”的关系可用如图的曲线表示,表示 c(N2)~t的曲线是乙.在此温度下,若起始充入4molN2和12molH2,反应刚达到平衡时,表示c(H2)的曲线上相应的点为B.
9.下列反应属于放热反应的是( )
| A. | 氢气还原氧化铜 | |
| B. | 氢气在氧气中燃烧 | |
| C. | Ba(OH)2•8H2O与NH4Cl反应 | |
| D. | 碳酸钙高温分解成氧化钙和二氧化碳 |



 广州亚运会“潮流”火炬采用具有广州民间特色的象牙雕镂空工艺,以水的和谐与火的激情交相凝聚为理念,寄托了亚洲人民共同推进和平与发展的期望.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
广州亚运会“潮流”火炬采用具有广州民间特色的象牙雕镂空工艺,以水的和谐与火的激情交相凝聚为理念,寄托了亚洲人民共同推进和平与发展的期望.火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: