题目内容
10.已知:A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机、轮船等制造业;B是一种盐,在工农业生产中用途较广;C、F、H为常见非金属单质;常温下C、F、I、E、J和K为气体;E对空气的相对密度为0.586;G为液体.有关物质间的转化关系如图(图中部分反应物或产物已省略):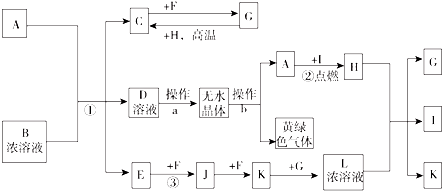
请填空:
(1)B的电子式为
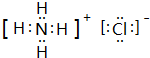 ;I分子的空间构型为直线形.
;I分子的空间构型为直线形.(2)反应②的实验现象为燃烧,发光发热,有黑色与白色固体物质生成.
(3)操作a必须在HCl气流中加热得无水物,其原因是抑制Mg2+的水解;操作b为熔融状态下电解.
(4)反应①的离子反应方程式为Mg+2NH4+═Mg2++H2↑+2NH3↑;反应③的化学反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(5)已知C的燃烧热为286 kJ/mol,请写出表示1g C在F中完全燃烧生成液体G的热化学反应方程式$\frac{1}{2}$H2(g)+$\frac{1}{4}$O2(g)=$\frac{1}{2}$H2O(g)△H=-143kJ/mol.
分析 E对空气的相对密度为0.586,其相对分子质量=0.586×29=17,且E为气体,可推知E为NH3,E与F连续反应得到K,且F、J、K均为气体,可推知F为O2、J为NO、K为NO2,常温常压下G为液体,与K反应得到L浓溶液,则G为H2O、L为HNO3,D系列转化得到黄绿色气体为Cl2,结合转化关系及元素守恒可推知B为NH4Cl,气体C与F反应得到G,可推知C为H2,非金属单质H与浓硝酸反应得到G、I、K,且金属A可以在I中燃烧得到H,可推知H为碳、I为CO2,A为Mg,结合转化关系可知D为MgCl2,据此解答.
解答 解:E对空气的相对密度为0.586,其相对分子质量=0.586×29=17,且E为气体,可推知E为NH3,E与F连续反应得到K,且F、J、K均为气体,可推知F为O2、J为NO、K为NO2,常温常压下G为液体,与K反应得到L浓溶液,则G为H2O、L为HNO3,D系列转化得到黄绿色气体为Cl2,结合转化关系及元素守恒可推知B为NH4Cl,气体C与F反应得到G,可推知C为H2,非金属单质H与浓硝酸反应得到G、I、K,且金属A可以在I中燃烧得到H,可推知H为碳、I为CO2,A为Mg,结合转化关系可知D为MgCl2,
(1)由上述分析可知,B的化学式为NH4Cl,电子式为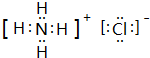 ,I为CO2,为直线形结构,
,I为CO2,为直线形结构,
故答案为: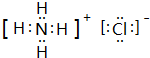 ;直线形;
;直线形;
(2)反应②为:反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,现象为:燃烧,发光发热,有黑色与白色固体物质生成,
故答案为:燃烧,发光发热,有黑色与白色固体物质生成;
(3)操作a是由氯化镁溶液得到氯化镁晶体,由于溶液中镁离子水解得到氢氧化镁与HCl,必须在HCl气流中加热得无水物,而不能直接加热浓缩,其原因是抑制Mg2+的水解;操作b是电解熔融的氯化镁得到Mg与氯气,
故答案为:抑制Mg2+的水解;熔融状态下电解;
(4)反应①的离子反应方程式为为:Mg+2NH4+═Mg2++H2↑+2NH3↑,反应③的化学反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:Mg+2NH4+═Mg2++H2↑+2NH3↑;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(5)已知氢气的燃烧热为286 kJ/mol,1g 氢气为0.5mol在氧气中完全燃烧生成液体水,放出的热量为134kJ,热化学反应方程式:$\frac{1}{2}$H2(g)+$\frac{1}{4}$O2(g)=$\frac{1}{2}$H2O(g)△H=-143kJ/mol,
故答案为:$\frac{1}{2}$H2(g)+$\frac{1}{4}$O2(g)=$\frac{1}{2}$H2O(g)△H=-143kJ/mol.
点评 本题考查无机物推断,E的相对密度及可以连续反应是推断突破口,再结合转化关系推断,需要学生熟练掌握Mg与二氧化碳的反应,在无机推断中经常涉及,反应①在中学没有涉及,是推断障碍,利用推断的产物判断发生的反应,难度较大.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案| A. | 生石灰氧化钙可用作食品的防氧化剂 | |
| B. | P2O5不可用作食品干燥剂 | |
| C. | 无水硅胶可用作食品干燥剂 | |
| D. | 加工后具有吸水性的植物纤维可用作食品干燥剂 |
| A. | 无色溶液中:NH4+、Ag+、PO43-、Cl- 能大量共存 | |
| B. | 水电离产生的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、Cl?、Br-一定能大量共存 | |
| C. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-能大量共存 | |
| D. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 |
| A. | 22.4 LCl2分别与铁和铜反应时,失电子数目均为NA | |
| B. | 1mol Na2O2与CO2足量反应时,转移NA个电子 | |
| C. | 12.0gNaHSO4固体中含有的阳离子数目为0.2NA | |
| D. | 1mol Na2O2晶体中含有的阴离子数目为2NA |
| A. | 将分别蘸有浓硝酸和浓氨水的玻璃棒相互靠近时,有白烟生成 | |
| B. | 硝酸具有酸的通性,如果与活泼金属反应,会有H2生成 | |
| C. | 浓硝酸能使活泼金属如铝、镁、锌、铁等发生“钝化” | |
| D. | 常温下,铜与稀HNO3反应很慢,是因为发生了“钝化” |
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOC-COOH | D. | CH3COOH |
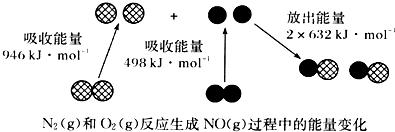
| A. | 1molN2(g)和NA个O2(g)反应放出的能量为180 kJ | |
| B. | 1molN2(g)和1molO2(g)具有总能量小于2molNO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| D. | 吸热反应一定需要加热才能发生 |
| A. | 乙烯、植物油和苯都能与氢气发生加成反应,是因为其结构中都含有碳碳双键 | |
| B. | 开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 制造玻璃是复杂的物理变化,玻璃的组成不同,性能不同 |