题目内容
15.一定量的某有机物和足量的钠反应,可得到气体VA L,等质量的该有机物与足量的纯碱溶液反应,可得到气体VB L.若同温、同压下VA>VB,则该有机物可能是( )| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOC-COOH | D. | CH3COOH |
分析 该有机物能与碳酸钠溶液反应,说明其含有-COOH;又由同温、同压下VA>VB.说明该有机物中还含有羟基,羟基不与碳酸钠反应.
解答 解:该有机物能与碳酸钠溶液反应,说明其含有-COOH;又由同温、同压下VA>VB.说明该有机物中还含有羟基,羟基不与碳酸钠反应,选项中只有HO(CH2)2COOH符合,故选:B.
点评 本题考查有机物结构确定,关键是对官能团性质的掌握,侧重考查学生分析推理能力,属于验证型题目.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
5.在氨水的下列性质中,可以证明它是弱电解质的是( )
①1摩/升氨水溶液的pH值约为11.6
②浓氨水可与水以任何比例互溶
③20毫升1摩/升氨水恰好与20毫升1摩/升HCl溶液完全反应
④在相同条件下,氨水的导电性比盐酸弱.
①1摩/升氨水溶液的pH值约为11.6
②浓氨水可与水以任何比例互溶
③20毫升1摩/升氨水恰好与20毫升1摩/升HCl溶液完全反应
④在相同条件下,氨水的导电性比盐酸弱.
| A. | ①、② | B. | ①、④ | C. | ①、③ | D. | ②、④ |
6.在一定温度下,向aL 密闭容器中加入 1molX 气体和 2molY 气体,发生如下反应:X(g)+2Y(g)?2Z(g)此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度相等 | |
| C. | 容器内 X、Y、Z 的浓度之比为 1:2:2 | |
| D. | 单位时间消耗 0.1molX 同时生成 0.2molZ |
7.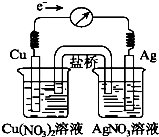 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )
 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )| A. | KNO3盐桥中的K+移向Cu(NO3)2溶液 | |
| B. | 当电流计指针指向0时,该反应达平衡,平衡常数K=0 | |
| C. | 若向硝酸银溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 | |
| D. | 向硝酸铜溶液中加入NaOH固体,随着NaOH量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 |
4.下列各组离子可以大量共存的是( )
| A. | 遇酚酞变红的溶液中:Na+、Cl-、Ba2+、CH3COO- | |
| B. | 常温下Kw/c(H+)=1×10-13mol/L的溶液中:SO42-、Fe2+、ClO-、NH4+ | |
| C. | 水电离出的c(H+)=10-10mol/L的溶液中:Na+、K+、Cl-、HCO3- | |
| D. | 0.5mol/LAlCl3溶液中可能大量存在:Ca2+、AlO2-、K+、CO32- |
16.下列说法正确的是( )
| A. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| B. | 向纯水中加入盐酸或金属钠都能使水的电离平衡逆向移动,水的离子积不变 | |
| C. | 向氯水中加入NaHCO3 (固体)可使溶液中c(HClO)增大 | |
| D. | 室温下,将浓度为0.1 mol•L-1 HF溶液加水稀释,其电离平衡常数和 c(H+)/c(HF)均不变 |
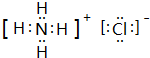 ;I分子的空间构型为直线形.
;I分子的空间构型为直线形.