题目内容
1.下列液体均处于25℃,有关叙述正确的是( )| A. | 无色溶液中:NH4+、Ag+、PO43-、Cl- 能大量共存 | |
| B. | 水电离产生的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、Cl?、Br-一定能大量共存 | |
| C. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-能大量共存 | |
| D. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 |
分析 A.离子之间结合生成沉淀;
B.水电离产生的c(H+)=10-12 mol•L-1的溶液,为酸或碱溶液;
C.使紫色石蕊试液变红的溶液,显酸性,离子之间发生氧化还原反应;
D.pH=-lgc(H+).
解答 解:A.Ag+分别与PO43-、Cl- 结合生成沉淀,不能共存,故A错误;
B.水电离产生的c(H+)=10-12 mol•L-1的溶液,为酸或碱溶液,该组离子之间不反应,可大量共存,故B正确;
C.使紫色石蕊试液变红的溶液,显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能共存,故C错误;
D.pH=-lgc(H+),则pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
9.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 1mol NH4+ 含有的电子总数为10NA | |
| B. | 1mol Mg 与足量盐酸反应时失去NA个电子 | |
| C. | 28g N2 所含原子数目为NA | |
| D. | 在101KPa、25℃条件下,11.2L H2 中含有的原子数目为NA |
16.下列溶液中,跟100mL 0.8mol•L-1NaCl溶液所含的Cl-物质的量浓度相同的是( )
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 200 mL 0.4 mol•L-1AlCl3溶液 | ||
| C. | 50 mL 1.6 mol•L-1NaCl溶液 | D. | 25 mL 0.8 mol•L-1HCl溶液 |
6.在一定温度下,向aL 密闭容器中加入 1molX 气体和 2molY 气体,发生如下反应:X(g)+2Y(g)?2Z(g)此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度相等 | |
| C. | 容器内 X、Y、Z 的浓度之比为 1:2:2 | |
| D. | 单位时间消耗 0.1molX 同时生成 0.2molZ |
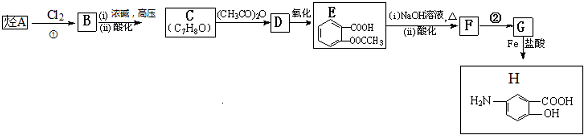
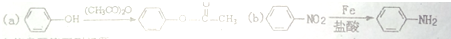
 ,F含有的官能团是羧基和酚羟基(填名称).
,F含有的官能团是羧基和酚羟基(填名称). .
.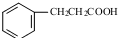 .
.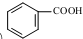 发生取代时,在羧基间位取代;②
发生取代时,在羧基间位取代;②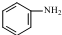 易发生氧化反应.以A为原料合成化合物
易发生氧化反应.以A为原料合成化合物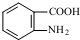 的设计合成路线为(其他试剂任选):
的设计合成路线为(其他试剂任选):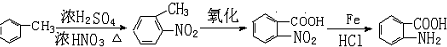 .
.

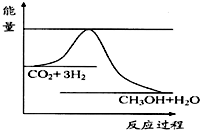 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.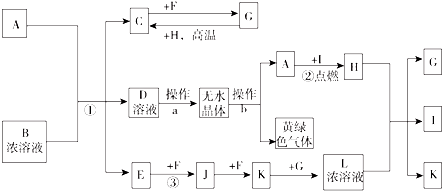
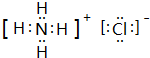 ;I分子的空间构型为直线形.
;I分子的空间构型为直线形.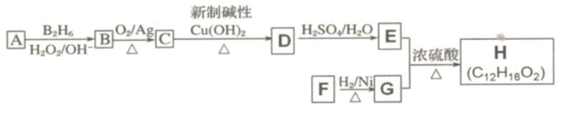
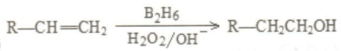
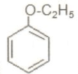 是同分异构体
是同分异构体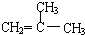 .
.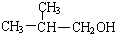 +O2$→_{△}^{Ag}$2
+O2$→_{△}^{Ag}$2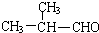 +2H2O.
+2H2O.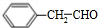 ;F分子中最多有15个原子共面.
;F分子中最多有15个原子共面.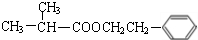 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$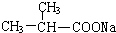 +
+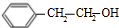 .
.