题目内容
明矾石经处理后得到明矾[KAl(SO4)2?12H2O].从明矾制备Al、K2SO4和H2SO4的工艺过程如图1示:

焙烧明矾的化学方程式为:4KAl(SO4)2?12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 ;
(2)从水浸后的滤液中得到K2SO4晶体的方法是 ;
(3)A12O3在一定条件下可制得AlN,其晶体结构如图2示,该晶体中Al的配位数是 ;
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是
(5)焙烧产生的SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=一197kJ/mol;
2H2O (g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol.
则SO3 (g)与H2O(l)反应的热化学方程式是 ;
(6)焙烧948吨明矾(M=474g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸 吨.

焙烧明矾的化学方程式为:4KAl(SO4)2?12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是
(2)从水浸后的滤液中得到K2SO4晶体的方法是
(3)A12O3在一定条件下可制得AlN,其晶体结构如图2示,该晶体中Al的配位数是
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是
(5)焙烧产生的SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=一197kJ/mol;
2H2O (g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol.
则SO3 (g)与H2O(l)反应的热化学方程式是
(6)焙烧948吨明矾(M=474g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸
考点:用盖斯定律进行有关反应热的计算,电解原理,镁、铝的重要化合物,制备实验方案的设计
专题:化学反应中的能量变化,化学键与晶体结构,电化学专题
分析:(1)依据化学方程式中元素化合价变化分析判断,元素化合价升高的做还原剂发生氧化反应;
(2)从水浸后的滤液中得到K2SO4晶体的方法是利用硫酸钾溶解度随温度变化,可以利用蒸发溶剂方法结晶析出;
(3)配位化合物中直接和中心原子(或离子)相联系的配位原子的数目;
(4)以Al和NiO(OH)为电极,铝做原电池 负极失电子发生氧化反应,NiO(OH)得到电子发生还原反应,结合原子守恒和电子守恒写出反应化学方程式;
(5)依据热化学方程式和盖斯定律计算得到;
(6)依据硫元素守恒计算得到.
(2)从水浸后的滤液中得到K2SO4晶体的方法是利用硫酸钾溶解度随温度变化,可以利用蒸发溶剂方法结晶析出;
(3)配位化合物中直接和中心原子(或离子)相联系的配位原子的数目;
(4)以Al和NiO(OH)为电极,铝做原电池 负极失电子发生氧化反应,NiO(OH)得到电子发生还原反应,结合原子守恒和电子守恒写出反应化学方程式;
(5)依据热化学方程式和盖斯定律计算得到;
(6)依据硫元素守恒计算得到.
解答:
解;(1)4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价.硫酸根离子中硫元素化合价从+6价变化为+4价,复印纸还原剂是硫单质,
故答案为:S;
(2)从水浸后的滤液中得到K2SO4晶体的方法是利用硫酸钾溶解度随温度变化不大,可以利用蒸发溶剂方法结晶析出晶体,
故答案为:蒸发结晶;
(3)依据晶体晶胞结构分析,结合配位数含义可知,每个铝原子和四个单原子相连,所以铝原子的配位数为4,
故答案为:4;
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,铝做负极失电子在氢氧化钠溶液中生成偏铝酸钠,反应的化学方程式为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2 ,
故答案为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2;
(5)2SO2(g)+O2(g)?2SO3(g)△H1=一197kJ/mol; ①
2H2O(g)=2H2O(1)△H2=一44kJ/mol; ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol. ③
依据盖斯定律③-①-②得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-304KJ/mol,
即反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-152KJ/mol,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-152KJ/mol;
(6)948 t明矾生成SO2物质的量为4500mol 故生成硫酸的质量m=4500×0.96×98÷0.98=432000Kg=432t.
故答案为:432.
故答案为:S;
(2)从水浸后的滤液中得到K2SO4晶体的方法是利用硫酸钾溶解度随温度变化不大,可以利用蒸发溶剂方法结晶析出晶体,
故答案为:蒸发结晶;
(3)依据晶体晶胞结构分析,结合配位数含义可知,每个铝原子和四个单原子相连,所以铝原子的配位数为4,
故答案为:4;
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,铝做负极失电子在氢氧化钠溶液中生成偏铝酸钠,反应的化学方程式为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2 ,
故答案为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2;
(5)2SO2(g)+O2(g)?2SO3(g)△H1=一197kJ/mol; ①
2H2O(g)=2H2O(1)△H2=一44kJ/mol; ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol. ③
依据盖斯定律③-①-②得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-304KJ/mol,
即反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-152KJ/mol,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-152KJ/mol;
(6)948 t明矾生成SO2物质的量为4500mol 故生成硫酸的质量m=4500×0.96×98÷0.98=432000Kg=432t.
故答案为:432.
点评:本题考查了氧化还原反应概念分析判断,晶体结构的理解分析,原电池反应的实质应用,热化学方程式和盖斯定律的计算,元素守恒的计算应用,题目难度中等.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
国内知名品牌三鹿毒奶粉事件震惊了国内外.三鹿奶粉因含有三聚氰胺而导致4名婴儿死亡,数千名婴儿患肾结石.如此严重的结果,使“三聚氰胺”这个原本对人很陌生的词语却频频出现在网络、电视、报纸等各种传媒上,成为人们谈话的焦点.从物质分类的角度看,问题奶粉属于( )
| A、单质 | B、化合物 |
| C、混合物 | D、氧化物 |
下列与有机物结构、性质相关的叙述错误的是( )
| A、用水可区分苯和溴苯 |
| B、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| C、甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 |
| D、蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 |
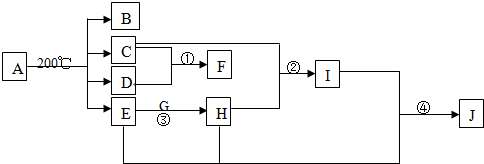
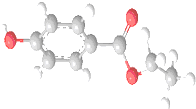 某相对分子质量为26的烃A,是一种重要的有机化工原料,以A为原料在不同的反应条件下可以转化为烃B、烃C,且B、C的核磁共振谱显示都只有一种氢.以C为原料通过下列方案可以制备具有广谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示.
某相对分子质量为26的烃A,是一种重要的有机化工原料,以A为原料在不同的反应条件下可以转化为烃B、烃C,且B、C的核磁共振谱显示都只有一种氢.以C为原料通过下列方案可以制备具有广谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示.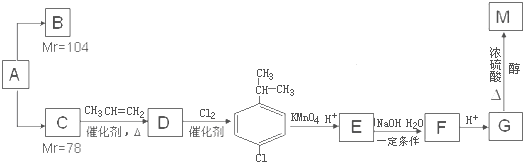
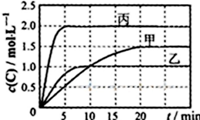 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).