题目内容
反应A(g)+2B(g)?C(g),△H<0达平衡后,当改变条件:①升温;②降温;③加压;④减压;⑤使用催化剂,能使反应速率加快同时C的平衡百分含量增加的是( )
| A、①③⑤ | B、②③ | C、③⑤ | D、③ |
考点:化学平衡的影响因素
专题:
分析:正反应为放热反应,升高温度,反应速率增大,平衡逆向移动,气体反应物的计量数之和大于生成物计量数之和,增大压强,平衡正向移动,以此解答该题.
解答:
解:①升温,平衡逆向移动,故错误;
②降温,反应速率减小,故错误;
③加压,反应速率增大,平衡正向移动,C的平衡百分含量增加,故正确;
④减压,反应速率减小,故错误;
⑤使用催化剂,平衡不移动,故错误.
故选D.
②降温,反应速率减小,故错误;
③加压,反应速率增大,平衡正向移动,C的平衡百分含量增加,故正确;
④减压,反应速率减小,故错误;
⑤使用催化剂,平衡不移动,故错误.
故选D.
点评:本题综合考查化学平衡的影响因素,为高频考点,侧重于学生的分析能量的考查,注意把握影响因素以及反应的特点,难度不大.

练习册系列答案
相关题目
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g)△H>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:下列说法中不正确的是( )
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:下列说法中不正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol?L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500 s内N2O5分解速率为2.96×10-3mol?L-1?s-1 | ||
| B、T1温度下的平衡常数K1=125(mol?L-1)3,平衡时N2O5的转化率为50% | ||
| C、T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | ||
D、达平衡后其他条件不变,将容器的体积压缩到原来的
|
麦考酚酸是一种有效的免疫抑制剂,其结构简式如图所示.下列有关麦考酚酸说法正确的是( )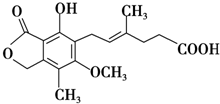

| A、分子式为C17H22O6 |
| B、能与FeCl3溶液发生显色反应,与浓溴水反应最多可消耗2molBr2 |
| C、1 mol麦考酚酸最多能与3 mol NaOH反应 |
| D、在一定条件下可发生加成、加聚、取代、消去反应 |

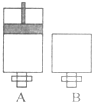 可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.
可逆反应O2(气)+2SO2(气)?2SO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),请回答下列问题.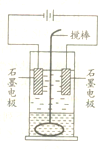 在玻璃圆筒中盛有两种无色的互不相溶的中性液体.上层液体中插有两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如图所示.接通电源,阳极周围的液体呈棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.回答:
在玻璃圆筒中盛有两种无色的互不相溶的中性液体.上层液体中插有两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如图所示.接通电源,阳极周围的液体呈棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.回答: