题目内容
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).
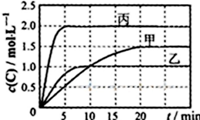
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图所示:
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
(2)x=
(3)T1
(4)T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为
考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法,化学平衡的计算
专题:化学平衡专题
分析:(1)由图可知,10min内甲容器中C的浓度变化量为1mol/L,根据v=
计算v(C)=
=0.1mol?L-1?min-1,再利用速率之比等于化学计量数之比计算v(A)=
v(C)=;
(2)在相同温度时,根据乙和丙平衡时的C的浓度和起始时A和B的浓度关系可以判断出压强对该平衡的影响,进而判断X的值;
(3)比较甲与乙可知,乙先到达平衡,故温度T1<T2,温度越高C的浓度越低,升高温度平衡向逆反应移动;
(4)根据平衡方程式,由前面的分析可知,x=1,根据平衡常数可计算出平衡时各物质的浓度,进而求得A的转化率.
| △c |
| △t |
| 1mol/L |
| 10min |
| 1 |
| 2 |
(2)在相同温度时,根据乙和丙平衡时的C的浓度和起始时A和B的浓度关系可以判断出压强对该平衡的影响,进而判断X的值;
(3)比较甲与乙可知,乙先到达平衡,故温度T1<T2,温度越高C的浓度越低,升高温度平衡向逆反应移动;
(4)根据平衡方程式,由前面的分析可知,x=1,根据平衡常数可计算出平衡时各物质的浓度,进而求得A的转化率.
解答:
解:(1)由图可知,10min内甲容器中C的浓度变化量为1mol/L,根据v=
计算v(C),再利用速率之比等于化学计量数之比计算v(A)=
v(C)=0.05mol?L-1?min-1,
故答案为:0.05;
(2)在相同温度时,根据图中乙和丙两条曲线可知,平衡时的C的浓度丙线是乙线的2倍,而起始时A和B的浓度容器丙的浓度是容器乙的2倍,也就是说,容器丙中压强是容器乙中2倍,而平衡没有移动,所以该反应前后气体计量数相等,所以x=1,
故答案为:1;
(3)比较甲与乙可知,乙先到达平衡,故温度T1<T2,温度越高C的浓度越低,升高温度平衡向逆反应移动,所以该反应的正反应为放热反应,
故答案为:<;小于;
(4)根据平衡方程式,由前面的分析可知,平衡方程式为A(g)+B(g)?2C(g),在T1时甲容器中,设新平衡时,A转化了xmol/L,利用三段式,
A(g)+B(g)?2C(g).
起始(mol/L) 3 1 0
转化(mol/L) 0.75 0.75 1.5
平衡(mol/L) 2.25 0.25 1.5
起始1(mol/L) 1 3 0
转化1(mol/L) x x 2x
平衡1(mol/L) 1-x 3-x 2x
所以K=
=4,在新平衡时有
=4,x=0.75,所以A的转化率为
×100%=75%,
故答案为:75%.
| △c |
| △t |
| 1 |
| 2 |
故答案为:0.05;
(2)在相同温度时,根据图中乙和丙两条曲线可知,平衡时的C的浓度丙线是乙线的2倍,而起始时A和B的浓度容器丙的浓度是容器乙的2倍,也就是说,容器丙中压强是容器乙中2倍,而平衡没有移动,所以该反应前后气体计量数相等,所以x=1,
故答案为:1;
(3)比较甲与乙可知,乙先到达平衡,故温度T1<T2,温度越高C的浓度越低,升高温度平衡向逆反应移动,所以该反应的正反应为放热反应,
故答案为:<;小于;
(4)根据平衡方程式,由前面的分析可知,平衡方程式为A(g)+B(g)?2C(g),在T1时甲容器中,设新平衡时,A转化了xmol/L,利用三段式,
A(g)+B(g)?2C(g).
起始(mol/L) 3 1 0
转化(mol/L) 0.75 0.75 1.5
平衡(mol/L) 2.25 0.25 1.5
起始1(mol/L) 1 3 0
转化1(mol/L) x x 2x
平衡1(mol/L) 1-x 3-x 2x
所以K=
| 1.52 |
| 2.25×0.25 |
| (2x)2 |
| (1-x)(3-x) |
| 0.75 |
| 1 |
故答案为:75%.
点评:本题主要考查了化学反应速率的计算、影响平衡移动的影响因素、转化率的计算等知识,中等难度,答题时注意运用化学平衡常数求平衡浓度.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列物质的分类正确的一组是( )
| A、单质:水银、石墨、氦气、HD |
| B、氧化物:金刚砂、Na2O2、双氧水、N2O4 |
| C、混合物:水玻璃、盐酸、胆矾、AgI胶体 |
| D、盐:碱式碳酸铜、小苏打、KI,Ba(OH)2 |

 A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.