题目内容
11.设NA为阿伏伽德罗常数的值.下列有关叙述正确的是( )| A. | 28 g乙烯和甲烷混合气体中的氢原子数为4NA | |
| B. | 标准状况下,11.2 LCH2Cl2含有的共价键数为2NA | |
| C. | 1mol SO2与 l mol O2反应生成的SO3分子数为NA | |
| D. | 过量铜与含0.4 molHNO3的浓硝酸反应,电子转移数大于0.2NA |
分析 A.利用极限的思想假设都是乙烯求氢原子数,假设都是甲烷求氢原子数,最终氢原子数在两者之间;
B.标况下CH2Cl2为液体;
C. SO2与 O2反应为可逆反应;
D.根据铜与浓硝酸、稀硝酸反应发生的电子转移物质的量不同进行分析.
解答 解:A.利用极限的思想假设28g都是乙烯,则n(C2H4)=$\frac{28g}{28g/mol}$=1mol,故n(H)=1mol×4=4mol,假设28g都是甲烷n(CH4)=$\frac{28g}{16g/mol}$=1.75mol,故n(H)=1.75mol×4=7mol,故最终氢原子数目在4mol~7mol两者之间,即4mol<n(H)<7mol,故混合气体中的氢原子数为4NA~7NA,故A错误;
B.标况下CH2Cl2为液体,不能使用气体摩尔体积,故B错误;
C. SO2与 O2反应为可逆反应,故不能进行彻底,故生成的SO3分子数小于NA,故C错误;
D.硝酸的物质的量为0.4mol,若与铜反应完全生成二氧化氮,转移电子物质的量为0.2mol,但是由于铜足量,浓硝酸随着反应的进行,后来变成了稀硝酸,生成了一氧化氮,转移的电子数增加,所以0.4mol硝酸与足量的铜反应,转移的电子数大于0.2mol,故D正确,
故选:D.
点评 本题考查了阿伏伽德罗常数的相关计算,注意标准状况下物质的状态是使用气体摩尔体积的因素之一,侧重考查学生分析能力,题目难度不大.

练习册系列答案
相关题目
19.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 炭粉中加入浓硝酸并加热,导出的气体通入少量澄清石灰水中 | 有红棕色气体产生,石灰水变浑浊 | 有NO2和CO2产生 |
| B | FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | 沉淀为BaSO3 |
| C | 钠块放在石棉网上加热 | 钠块熔化,最终得淡黄色固体 | 熔点:Na2O2>Na |
| D | 蔗糖中滴入浓硫酸并不断搅拌 | 产生黑色蓬松多孔固体 | 浓硫酸具有吸水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
6.下列图示与对应的叙述相符合的是( )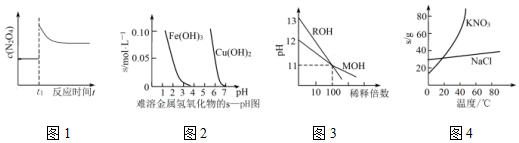

| A. | 图1表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 | |
| B. | 图2表示除去CuSO4溶液中的Fe3+可采用加入CuO调节溶液pH到4~5 | |
| C. | 图3表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,则碱性:MOH>ROH | |
| D. | 图4为KNO3和NaCl溶解度曲线,若除去NaCl中少量的KNO3,可在较高温度下制得浓溶液后,再冷却结晶、过滤、洗涤、干燥得纯净NaCl |
16.下列化学实验对应的现象及结论都正确且两者具有因果关系的是( )
| 实验 | 现象 | 结论 | |
| A | 向浓度均为0.1mol/L的NaHCO3溶液和NaHSO3溶液中滴加几滴酚酞试剂 | 前者溶液变红,后者不变色 | NaHCO3水解,而NaHSO3不水解 |
| B | 向NaAlO2溶液中通入NH3 | 白色沉淀 | Al(OH)3不能溶解在弱碱中 |
| C | 向滴有品红的水中通入SO2 | 溶液红色褪去 | SO2具有氧化性 |
| D | 将充有NO2的密闭烧瓶放入热水中 | 烧瓶内气体颜色变深 | NO2生成N2O4的反应中,△H<0 |
| A. | A | B. | B | C. | C | D. | D |
3.丙烯酸羟乙酯(Ⅲ)可用作电子显微镜的脱水剂,可用下列方法制备:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 化合物Ⅰ能与NaHCO3溶液反应生成CO2 | |
| B. | 可用Br2的CCl4溶液检验化合物Ⅲ中是否混有化合物I | |
| C. | 化合物Ⅱ与乙醛互为同分异构体 | |
| D. | 化合物Ⅲ水解可生成2种有机物 |
20.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 0.5L 2mol/L盐酸中含有NA氯化氢分子 | |
| B. | 在标准状况下,2.24L氖气含有NA个电子 | |
| C. | 常温下,24gC2H518OH分子中含有3.5NA个共价键 | |
| D. | 若2H2S+O2═2S+2H2O生成3.2g硫,则反应过程中转移0.1NA个电子 |
14.化学与生产、生活、环境等社会实际密切相关.下列叙述正确的是( )
| A. | “滴水石穿、绳锯木断”涉及到化学变化 | |
| B. | 乙酸乙酯在H218O中水解,产物乙醇中将含有18O同位素 | |
| C. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |

 .
.