题目内容
用铂电极电解CuCl2与CuSO4的混合溶液(浓度均为2mol/L)50mL,当阴极析出9.6g固体时,标准状况下阳极得到的气体是( )
| A、2.24L | B、2.8L |
| C、3.36L | D、4.48L |
考点:电解原理
专题:电化学专题
分析:用铂电极电解CuCl2与CuSO4的混合溶液(浓度均为2mol/L)50mL,溶液中n(Cu2+)=0.05L×2mol/L×2=0.2mOL;n(Cl-)=0.2mol;阴极析出9.6g固体为铜,发生的电极反应为:阳极:4Cl--2e-=Cl2↑;4OH--4e-=2H2O+O2↑;阴极:Cu2++2e-=Cu,依据电极反应电子守恒计算.
解答:
解:用铂电极电解CuCl2与CuSO4的混合溶液(浓度均为2mol/L)50mL,溶液中n(Cu2+)=0.05L×2mol/L×2=0.2mol;n(Cl-)=0.2mol;阴极析出9.6g固体为铜物质的量为n(Cu)=
=0.15mol,依据电极反应电子守恒;结合发生的电极反应计算:
阴极:2Cu2++4e-=2Cu
0.3mol 0.15mol
阳极:2Cl--2e-=Cl2↑;
2 2 1
0.2mol 0.2mol 0.1mol
4OH--4e-=2H2O+O2↑
4 1
0.1mol 0.025mol
所以生成9.6g铜时,阳极 生成气体 0.1mol+0.025mol=0.125mol;
标准状况下气体体积为0.125mol×22.4L/mol=2.8L;
故选B.
| 9.6g |
| 64g/mol |
阴极:2Cu2++4e-=2Cu
0.3mol 0.15mol
阳极:2Cl--2e-=Cl2↑;
2 2 1
0.2mol 0.2mol 0.1mol
4OH--4e-=2H2O+O2↑
4 1
0.1mol 0.025mol
所以生成9.6g铜时,阳极 生成气体 0.1mol+0.025mol=0.125mol;
标准状况下气体体积为0.125mol×22.4L/mol=2.8L;
故选B.
点评:本题考查了混合电解的计算应用,电极反应,电极判断,电子守恒的计算应用时解题关键,题目难度中等.

练习册系列答案
相关题目
 有一反应,由X与Y化合生成Z.其反应如右:2X+3Y=2Z,反应物X与生成物Z的质量关系如图.下列说法正确的是( )
有一反应,由X与Y化合生成Z.其反应如右:2X+3Y=2Z,反应物X与生成物Z的质量关系如图.下列说法正确的是( )| A、有4g的Z生成时,则消耗Y 6g |
| B、X、Y、Z的摩尔质量之比为3:2:6 |
| C、2mol X质量与3mol Y质量之和等于2mol Z的质量 |
| D、消耗2mol X时,在标准状况下,生成Z的体积为44.8L |



 图中装置中仪器的名称:
图中装置中仪器的名称: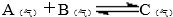 )前起始体积相同、且容积固定的容器中发生上述反应开始时放入1mol A和1mol B到达平衡后生成bmol C.将b与(1)小题中的a进行比较
)前起始体积相同、且容积固定的容器中发生上述反应开始时放入1mol A和1mol B到达平衡后生成bmol C.将b与(1)小题中的a进行比较 (1)已知:H2(g)+O2(g)═H2O(g),反应过程中能量变化如图所示,则:
(1)已知:H2(g)+O2(g)═H2O(g),反应过程中能量变化如图所示,则: