题目内容
13.下列叙述正确的是( )| A. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔 | |
| B. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 | |
| C. | 地球上大量的溴蕴藏在大海中,因此溴被称为“海洋元素” | |
| D. | 新制氯水应保存在无色试剂瓶中 |
分析 A.1803年道尔顿模型 原子是一个坚硬的实心小球;1904年汤姆生(J.J.Thompson)模型 原子是一个带正电荷的球,电子镶嵌在里面,原子好似一块“葡萄干布丁”;1911年卢瑟福提出行星模型:原子的大部分体积是空的,电子按照一定轨道围绕着一个带正电荷的很小的原子核运转;1913年玻尔模型电子不是随意占据在原子核的周围,而是在固定的层面上运动,当电子从一个层面跃迁到另一个层面时,原子便吸收或释放能量;
B.原子吸收光谱只能确定某物质中有什么金属元素,不能测岀非金属;
C.地球上99%以上的溴都蕴藏在汪洋大海中;
D.新制的氯水中含有次氯酸,次氯酸见光容易分解,应该避光保存.
解答 解:A.提出原子结构模型的科学家按时间先后依次是:道尔顿、汤姆生、卢瑟福、玻尔,故A错误;
B.借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些金属元素,故B错误;
C.地球上99%以上的溴都蕴藏在汪洋大海中,故溴有“海洋元素”的美称,故C正确;
D.新制的氯水见光容易分解,应该避光保存,所以新制的氯水通常保存在棕色玻璃试剂瓶中,故D错误;
故选C.
点评 本题考查化学史、常用仪器、物质的保存等知识,主要是物质性质的理解应用,掌握基础是关键,题目难度不大.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
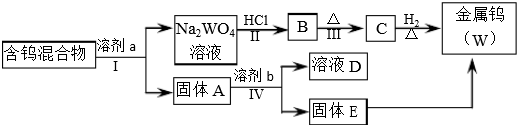
3.分离混合物在工业生产中应用广泛.某含有金属钨(W)、WO2、WO3、W2O5的混合物,欲从该混合物中分离出WO3和W2O5,并冶炼金属钨,其流程示意图如所示.
请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
(1)步骤Ⅰ和Ⅳ均要进行的操作是过滤.
(2)步骤Ⅱ、Ⅲ反应的化学方程式分别是Na2WO4+2HCl=H2WO4+2NaCl、H2WO4$\frac{\underline{\;\;△\;\;}}{\;}$WO3+H2O.
(3)WO3既属于金属氧化物,也属于酸性氧化物,与NaOH溶液反应的离子方程式是WO3+2OH-=WO42-+H2O.
(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是将WO3溶解同时又能保证不被氧化W2O5.
(5)步骤Ⅳ可将W2O5分离出来,选用的试剂b是50g/L Na2CO3溶液,固体E中含有的物质是W、WO2,D中溶质是Na2WO4.

请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
| 溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
| ①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未检出 | 未检出 |
(2)步骤Ⅱ、Ⅲ反应的化学方程式分别是Na2WO4+2HCl=H2WO4+2NaCl、H2WO4$\frac{\underline{\;\;△\;\;}}{\;}$WO3+H2O.
(3)WO3既属于金属氧化物,也属于酸性氧化物,与NaOH溶液反应的离子方程式是WO3+2OH-=WO42-+H2O.
(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是将WO3溶解同时又能保证不被氧化W2O5.
(5)步骤Ⅳ可将W2O5分离出来,选用的试剂b是50g/L Na2CO3溶液,固体E中含有的物质是W、WO2,D中溶质是Na2WO4.
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1.12LCCl4含有Cl原子数目为0.4NA | |
| B. | 标准状况下,2.24L氯气中含有的电子总数为3.4mol | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 39gNa2O2与足量H2O反应,转移电子数为NA |
8.把0.01mol/LHAc溶液和0.02mol/LNaOH溶液以等体积混和充分反应后,加热蒸干,灼烧,最终残留固体为( )
| A. | Na2CO3 | B. | NaOH | ||
| C. | CH3COONa NaOH | D. | Na2CO3 CH3COONa |
18.下列物质按一定的分类方法属于同一类的是( )
| A. | 酸性氧化物:CO2、SO2、SiO2、Na2O | B. | 盐:Na2CO3、KHCO3、Cu2(OH)2CO3 | ||
| C. | 非电解质:酒精、蔗糖、NH3、次氯酸 | D. | 混合物:液氯、盐酸、胆矾、氯水 |
2.下列说法正确的是( )
| A. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| D. | 高纯度的硅单质用于制作光导纤维 |
 .
.