题目内容
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下含有NA个氦原子的氦气的体积约为11.2L | |
| B. | 1 L 0.1 mol/LNaHSO4溶液中含有0.1NA个HSO4- | |
| C. | 标准状况下,22.4 L CCl4所含的分子数约为NA | |
| D. | CO和N2组成的42g混合气体中原子的个数为3NA |
分析 A、氦气为单原子分子;
B、NaHSO4溶液中无硫酸氢根离子;
C、标况下四氯化碳为液态;
D、CO和氮气的摩尔质量均为28g/mol.
解答 解:A、氦气为单原子分子,故含NA个氦原子的氦气的物质的量为1mol,故在标况下为22.4L,故A错误;
B、NaHSO4溶液中无硫酸氢根离子,故溶液中无硫酸氢根,故B错误;
C、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、CO和氮气的摩尔质量均为28g/mol,故42g混合物的物质的量为1.5mol,而两者均含2个原子,故1.5mol混合气体中含3NA个原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.在PH=1的溶液中,下列各组离子能大量共存的是( )
| A. | Al3+、Fe2+、Ba2+、NO3- | B. | Na+、K+、HCO3-、Cl- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | NH4+、Fe3+、SO42-、Cl- |
 某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
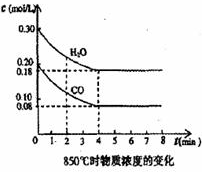 在一体积为 10L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图:
在一体积为 10L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图: