题目内容
14.写出下列化学反应的离子方程式(1)氢氧化钡溶液和硫酸溶液反应Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
(2)氧化铁和稀盐酸反应:Fe2O3+6H+═2Fe3++3H2O
根据下列离子方程式,各写一个符合条件的化学方程式
(3)Zn+2H+═Zn2++H2↑Zn+2HCl=ZnCl2+H2↑
(4)HCO3-+H+═CO2↑+H2ONaHCO3+HCl═+NaCl+CO2↑+H2O.
分析 (1)反应生成硫酸钡和水,硫酸钡、水在离子反应中均保留化学式;
(2)反应生成氯化铁和水;
(3)Zn+2H+═Zn2++H2↑可表示Zn与非氧化性酸的离子反应;
(4)HCO3-+H+═CO2↑+H2O可表示碳酸氢盐与强酸的反应.
解答 解:(1)氢氧化钡溶液和硫酸溶液反应的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(2)氧化铁和稀盐酸反应的离子反应为Fe2O3+6H+═2Fe3++3H2O,故答案为:Fe2O3+6H+═2Fe3++3H2O;
(3)符合Zn+2H+═Zn2++H2↑的化学反应如Zn+2HCl=ZnCl2+H2↑,故答案为:Zn+2HCl=ZnCl2+H2↑;
(4)符合HCO3-+H+═CO2↑+H2O 的化学反应如NaHCO3+HCl═+NaCl+CO2↑+H2O,故答案为:NaHCO3+HCl═+NaCl+CO2↑+H2O.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意保留化学式的物质及离子反应的意义,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
4.有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol•L-1,含有硝酸的浓度为1mol•L-1,现向其中加入过量铁粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
| A. | 89.6mL | B. | 112mL | C. | 224mL | D. | 672mL |
2.下列各组物质,前者为强电解质,后者为非电解质的是( )
| A. | 硫酸、氯气 | B. | 苛性钾、二氧化硫 | C. | 氯化氢、金刚石 | D. | 氯化钠、硫化氢 |
3.对于反应C2H4(g)→C2H2(g)+H2(g),2CH4(g)→C2H4(g)+2H2(g)都是吸热反应,观察下列反应,判定①②③中的△H1,△H2,△H3大小顺序是( )
①C(s)+2H2(g)→CH4(g)△H1
②2C(s)+H2(g)→C2H2(g)△H2
③2C(s)+2H2(g)→C2H4 (g)△H3.
①C(s)+2H2(g)→CH4(g)△H1
②2C(s)+H2(g)→C2H2(g)△H2
③2C(s)+2H2(g)→C2H4 (g)△H3.
| A. | △H2>△H3>2△H1 | B. | △H1>△H2>△H3 | C. | △H2>△H1>△H3 | D. | △H3>△H2>2△Hl |
4. 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )| 选项 | 气体 | A中试剂 | B中试剂 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 品红溶液 |
| B | Cl2、HCl | 浓硫酸 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | C2H4、CH4 | 酸性KMnO4溶液 | 溴的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
 (1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
(1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气. ,其中-R为烃基.
,其中-R为烃基.
 ;C的结构简式
;C的结构简式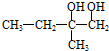 .
. .
.