题目内容
15.向0.1mol•L-1 CH3COOH溶液中加入少量CH3COONa晶体或加水稀释时,都会引起( )| A. | 溶液的pH增大 | B. | CH3COOH的电离程度增大 | ||
| C. | 溶液的导电能力减小 | D. | 溶液中n(H+)减小 |
分析 CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度减小,溶液的pH增大,导电能力减弱,溶液中c(H+)减小;CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,溶液的PH增大,导电能力增强,溶液中c(H+)减小,由此分析解答.
解答 解:A.CH3COOH溶液加水稀释,平衡向正反应方向移动,溶液的PH增加,CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,溶液的pH增加,故A正确;
B.CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度增大,加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,故B错误;
C.CH3COOH溶液加水稀释,离子浓度减小,溶液的导电能力减弱,加入少量CH3COONa晶体时,离子浓度增大,溶液的导电能力增强,故C错误;
D.加水稀释,促进醋酸电离,但溶液中氢离子浓度减小,加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,氢离子浓度减小,故D错误;
故选A.
点评 本题考查外界条件对电离平衡的影响,重点考查离子浓度以及同离子效应对电离平衡的影响,注意总结影响因素以及平衡移动的方向的判断.

练习册系列答案
相关题目
6.属于有机物的是( )
| A. | 葡萄糖 | B. | 干冰 | C. | 碳酸 | D. | 木炭 |
3.电解饱和食盐水时,阴极生成的气体是 ( )
| A. | H2 | B. | Cl2 | C. | HCl | D. | O2 |
10.质量相等的下列物质中,所含原子数最少的是( )
| A. | H2O | B. | NH3 | C. | CH4 | D. | H3PO4 |
20.氨水呈弱碱性的主要原因是( )
| A. | 通常情况下,氨的溶解度不大 | B. | 溶于水的氨分子只有少量电量 | ||
| C. | 氨水中的NH3•H2O电离出少量OH- | D. | 氨本身的碱性弱 |
7.在标准状况下,7.84升甲烷完全燃烧后生成二氧化碳和液态水,同时放出311.4kJ的热量.则甲烷燃烧的热化学方程式是( )
| A. | CH4+2O2→CO2+2H2O+311.4kJ | B. | CH4(g)+2O2(g)→CO2(g)+2H2O(l)+311.4kJ | ||
| C. | CH4(g)+2O2(g)→CO2(g)+2H2O(l)+889.7kJ | D. | CH4(g)+2O2(g)→CO2(g)+2H2O(g)+889.7kJ |
4.下列电离方程式书写错误的是( )
| A. | NaHCO3=Na++H++CO32- | B. | NH4NO3=NH4++NO3- | ||
| C. | Na2SO4=2Na++SO42- | D. | Ba(OH)2=Ba2++2OH- |
5.已知:SO32-+I2+H2O═SO42-+2I-+2H+,某无色溶液中可能含有Na+、NH4+、Cu2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等.向溶液中滴加少量氯水,溶液呈无色(不考虑盐类的水解及水的电离).下列关于该溶液的判断正确的是( )
| A. | 肯定不含I- | B. | 不能确定是否含有SO42- | ||
| C. | 至少含有Na+、NH4+、K+中的两种 | D. | 可能含有Cu2+ |
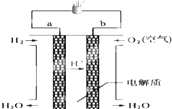 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.