题目内容
4.下列电离方程式书写错误的是( )| A. | NaHCO3=Na++H++CO32- | B. | NH4NO3=NH4++NO3- | ||
| C. | Na2SO4=2Na++SO42- | D. | Ba(OH)2=Ba2++2OH- |
分析 A.碳酸氢钠电离出钠离子、碳酸氢根离子;
B.硝酸铵为强电解质,在溶液中完全电离;
C.硫酸钠在溶液中完全电离出钠离子和硫酸根离子;
D.氢氧化钡为强电解质,在溶液中完全电离出钡离子和氢氧根离子.
解答 解:A.碳酸氢钠为强电解质,在溶液中完全电离,其电离方程式为:NaHCO3=Na++HCO3-,故A错误;
B.硝酸铵在溶液中完全电离出硝酸根离子和铵根离子,电离方程式为:NH4NO3=NH4++NO3-,故B正确;
C.硫酸钠为强电解质,在溶液中完全电离,电离方程式为:Na2SO4=2Na++SO42-,故C正确;
D.氢氧化钡在溶液中完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,故D正确;
故选A.
点评 本题考查了电离方程式的书写,题目难度不大,电离方程式的书写原则为解答关键,注意掌握强弱电解质的概念及判断方法,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
15.向0.1mol•L-1 CH3COOH溶液中加入少量CH3COONa晶体或加水稀释时,都会引起( )
| A. | 溶液的pH增大 | B. | CH3COOH的电离程度增大 | ||
| C. | 溶液的导电能力减小 | D. | 溶液中n(H+)减小 |
12.下列叙述中正确的是( )
| A. | N、O、P元素的非金属性依次减弱 | |
| B. | Na、Mg、Al元素最高化合价依次升高 | |
| C. | Na、Li、K原子的电子层数依次增多 | |
| D. | P、Cl、S元素最高价氧化物对应的水化物酸性依次增强 |
9.水壶长时间使用后,会形成一层水垢(主要成分为CaCO3).厨房中的下列物质可用来清除水垢的是( )
| A. | 白醋 | B. | 食盐 | C. | 白酒 | D. | 小苏打 |
13.下列反应不属于氧化还原反应的是( )
| A. | Cl2+H2O=HCl+HClO | B. | Fe+CuSO4=FeSO4+Cu | ||
| C. | 2NaHCO3 $\frac{\underline{\;△\;}}{\;}$Na2CO3+H2O+CO2 | D. | Cl2+2FeCl2=3FeCl3 |
7.下列表示物质形成过程的电子式正确的是( )
| A. |  | |
| B. |  | |
| C. |  | |
| D. |  |
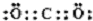 ,属于两性氢氧化物的电离方程式Al3++3OH-?Al(OH)3 ?H++AlO2-+H2O.
,属于两性氢氧化物的电离方程式Al3++3OH-?Al(OH)3 ?H++AlO2-+H2O.