题目内容
18.以NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 在标准状况下,NA个H2O 分子所占体积约为22.4L | |
| B. | 0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体在标准状况下的体积约为22.4 L | |
| C. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1 NA | |
| D. | 0.5mol/L的NaCl溶液中Cl-的个数为是0.5NA |
分析 A.标准状况下,水的状态不是气态;
B.根据V=nVm计算该混合气体在标况下的体积;
C.常温常压下,不能使用标况下的气体摩尔体积计算;
D.缺少溶液体积,无法计算溶液中含有氯离子的物质的量.
解答 解:A.标况下水不是气体,不能使用标况下的气体摩尔体积计算水的体积,故A错误;
B.0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体的总物质的量为:0.1mol+0.2mol+0.3mol+0.4mol=1mol,在标准状况下1mol该混合气体的体积约为22.4 L,故B正确;
C.不是标准状况下,不能使用标况下的气体摩尔体积计算混合气体的物质的量,故C错误;
D.没有告诉0.5mol/L的NaCl溶液的体积,无法计算氯离子的物质的量及数目,故D错误;
故选B.
点评 本题考查了物质的量的计算,题目难度不大,明确标准状况下气体摩尔体积的使用条件为解答关键,注意熟练掌握物质的量与其它物理量之间的转化关系,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
相关题目
1.化学实验有助于理解化学知识,形成化学观念.下列实验操作正确的是( )
| A. |  称量药品 | B. |  过滤 | C. |  分离乙醇和水 | D. |  收集HCI |
2.在恒温恒的密闭容器中,发生反应:A(g)+3B(g)?nC(g).Ⅰ.将1molA和3molB在一定条件下反应,达平衡时C的体积分数为x;Ⅱ.若起始时A、B、C投入的物质的量分别为a、b、c(均不为零),平衡时C的体积分数液为x,下列说法正确的是( )
| A. | 若Ⅰ达平衡时,A、B、C各增加1mol,则C转化率将一定增大 | |
| B. | 若向Ⅰ平衡体系中在加入1molA和3molB,C的体积分数若大于x,可断定n>3 | |
| C. | 若Ⅱ体系起始物质的量满足9a+c=3b,则可判断n=3 | |
| D. | 若n=2,则Ⅱ体系起始物质的量应满足2a+1<b<3 |
6.下列说法正确的是:(NA表示阿伏加德罗常数)( )
| A. | 标准状况下,22.4 L HF中含有的氟原子数目为NA | |
| B. | 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+) | |
| C. | 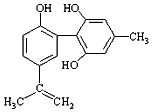 1mol如图物质与浓溴水反应时通常最多消耗Br2为4mol | |
| D. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0,一定条件下,使用催化剂能加快反应速率并提高反应 物的平衡转化率 |
13.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 100ml0.1mol•L-1Na2SO4溶液中,微粒总数是0.03NA | |
| B. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 | |
| C. | 常温常压下,32g O2-中所含电子的数目为17NA | |
| D. | 标准状况下,11.2L酒精含有的分子数为0.5NA |
8.已知25℃时,AgCl的Ksp=1.8×10-10,下列说法正确的是( )
| A. | 在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数 | |
| B. | 在任何含AgCl固体的溶液中都存在c(Ag+)=c(Cl-) | |
| C. | 向饱和AgCl水溶液中加入盐酸,其Ksp值变大 | |
| D. | 将足量AgCl固体投入100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)=9×10-10mol/L |
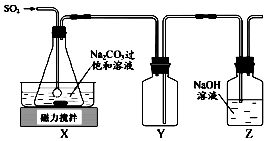 焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如图所示.
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如图所示.