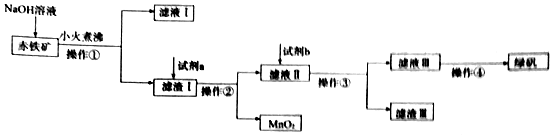
题目内容
2.在恒温恒的密闭容器中,发生反应:A(g)+3B(g)?nC(g).Ⅰ.将1molA和3molB在一定条件下反应,达平衡时C的体积分数为x;Ⅱ.若起始时A、B、C投入的物质的量分别为a、b、c(均不为零),平衡时C的体积分数液为x,下列说法正确的是( )| A. | 若Ⅰ达平衡时,A、B、C各增加1mol,则C转化率将一定增大 | |
| B. | 若向Ⅰ平衡体系中在加入1molA和3molB,C的体积分数若大于x,可断定n>3 | |
| C. | 若Ⅱ体系起始物质的量满足9a+c=3b,则可判断n=3 | |
| D. | 若n=2,则Ⅱ体系起始物质的量应满足2a+1<b<3 |
分析 在恒温恒容的密闭容器中,将1molA和3molB在一定条件下反应,达平衡时C的体积分数为x,若起始时A、B、C投入的物质的量分别为a、b、c,平衡时C的体积分数也为x,二者应为等效平衡,应存在a+$\frac{1}{n}$c=1,b+$\frac{2}{n}$c=3,以此解答该题.
解答 解:在恒温恒容的密闭容器中,将1molA和3molB在一定条件下反应,达平衡时C的体积分数为x,若起始时A、B、C投入的物质的量分别为a、b、c,平衡时C的体积分数也为x,二者应为等效平衡,应存在a+$\frac{1}{n}$c=1,b+$\frac{2}{n}$c=3,
A.由于n值不确定,则若Ⅰ达平衡时,A、B、C各增加1mol,B的转化率不能确定,故A错误;
B.因容器体积不变,若x=3时,C的体积分数应为x,现大于x,x应小于3,促进平衡正向移动,故B错误;
C.由恒温恒容时,当a、b、c为起始物质的量,平衡时C的体积分数仍为x,a+$\frac{1}{n}$c=1,b+$\frac{2}{n}$c=3,若n=3,二者联式可得9a+c=3b,故C正确;
D.由恒温恒容时,当a、b、c为起始物质的量,平衡时C的体积分数仍为x,a+$\frac{1}{n}$c=1,b+$\frac{2}{n}$c=3,若n=2,二者联式可得b=2a+1,故D错误;
故选C.
点评 本题考查化学平衡,题目难度较大,注意从等效平衡的角度解答该题,易错点为A,注意n不确定,A、B、C各增加1mol,B的转化率可能增加,也可能不变.

练习册系列答案
相关题目
12.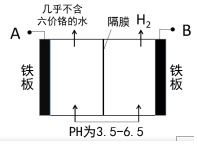 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )
 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )| A. | A接电源正极 | |
| B. | 阳极区溶液中发生的氧化还原反应为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O | |
| C. | 阴极区附近溶液pH减小 | |
| D. | 若不考虑气体的溶解,当收集到H2 13.44L时(标况),有0.1mol Cr2O72-被还原 |
13.下列物质中互为同分异构体的是( )
| A. | 麦芽糖和果糖 | B. | 蔗糖和麦芽糖 | C. | 淀粉和纤维素 | D. | 果糖和葡萄糖 |
10.已知反应:NaH+H2O=H2+NaOH,对该反应的判断正确的是( )
| A. | 1mol NaH参加反应失去1mol电子 | B. | 每生成1mol H2转移2mol电子 | ||
| C. | NaH既是氧化剂,又是还原剂 | D. | NaOH是氧化产物 |
17.(1)甲同学利用下列装置来进行铜跟浓硫酸反应实验.
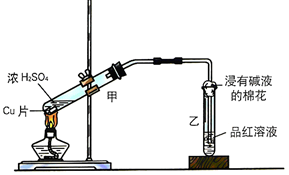
①写出甲装置中发生的主要反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜.若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是乙,原因是甲有二氧化硫产生,污染空气,乙无污染,硫酸利用率高.
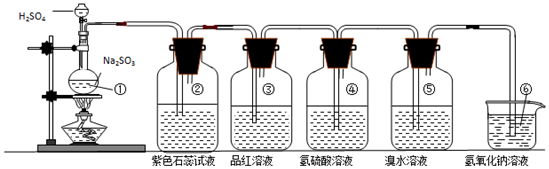
(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在表中,请完成以下表格:

①写出甲装置中发生的主要反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜.若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是乙,原因是甲有二氧化硫产生,污染空气,乙无污染,硫酸利用率高.

(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在表中,请完成以下表格:
| 装置序号 | 实验现象或作用 | 实验结论或化学方程式 |
| ① | 有气泡产生 | 化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑ |
| ② | 紫色石蕊试液变红色 | 证明SO2溶于水显酸性 |
| ③ | 品红溶液褪色 | 证明SO2具有漂白性 |
| ④ | 溶液变浑浊 | 证明SO2具有氧化性 |
| ⑤ | 溴水褪色 | 证明SO2具有还原性 |
| ⑥ | 吸收尾气 | 证明SO2属于酸性氧化物 |
7.在碱性溶液中能大量共存且为无色透明的溶液是( )
| A. | K+,Cl-,MnO4-,SO42- | B. | Na+,SiO32-,NO3-,CO32- | ||
| C. | Na+,NO3-,SO42-,HCO3- | D. | Na+,SO42-,S2-,ClO- |
1.设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 62g白磷(白磷P4为正四面体结构P原子位于顶点)中含P-P共价键为6NA | |
| B. | 1molCl2全部发生反应时,无论什么时候都是得到的电子数一定为2NA | |
| C. | 若一个CO的质量为a g,则CO的摩尔质量为a NA | |
| D. | 常温下10LpH=13的NaOH溶液中含有的OH-离子数为NA |
18.以NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 在标准状况下,NA个H2O 分子所占体积约为22.4L | |
| B. | 0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体在标准状况下的体积约为22.4 L | |
| C. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1 NA | |
| D. | 0.5mol/L的NaCl溶液中Cl-的个数为是0.5NA |