题目内容
12.由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH${\;}_{4}^{+}$、Mg2+、Ba2+、CO${\;}_{3}^{2-}$.、SO${\;}_{4}^{2-}$.
将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
| 实验序号 | 实验内容 | 实验结果 |
| a | 加AgNO3溶液 | 有白色沉淀生成 |
| b | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积) |
| c | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27 g,第二次称量读数为2.33 g |
(1)根据实验1对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”);
(2)根据实验1~3判断原混合物中一定不存在的离子是Mg2+、Ba2+;
(3)若溶液中含有Cl-,则K+的物质的量应满足的条件是c(K+)>0.2mol/L.
分析 a中加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
b中加足量的NaOH溶液,加热,1.12L气体为氨气,氨气的物质的量为0.05mol,溶液中一定含有NH4+,并且物质的量为0.05mol;
c中2.33g为硫酸钡,硫酸钡的物质的量为0.01mol;6.27g为硫酸钡和碳酸钡,碳酸钡的质量为6.27g-2.33g=3.94g,物质的量为0.02mol;溶液中一定存SO42-、CO32-,根据离子共存可知,一定不存在Mg2+、Ba2+,结合电荷守恒解答该题.
解答 解:a中加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
b中1.12L为氨气,氨气的物质的量为0.05mol,溶液中一定含有NH4+,并且物质的量为0.05mol;
c中2.33g为硫酸钡,硫酸钡的物质的量为0.01mol;6.27g为硫酸钡和碳酸钡,碳酸钡的质量为6.27g-2.33g=3.94g,物质的量为0.02mol;溶液中一定存SO42-、CO32-,根据离子共存可知,一定不存在Mg2+、Ba2+,
(1)由上述分析可知,加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-,不能确定Cl-是否存在,
故答案为:不能确定;
(2)根据离子共存可知,一定不存在Mg2+、Ba2+,故答案为:Mg2+、Ba2+;
(3)由溶液中电荷守恒可知,溶液中一定含有K+,溶液中电荷守恒c(K+)+c(NH4+)=2c(SO42-)+2c((CO32-),c(K+)=0.2mol/L,溶液中可能存在Cl-,所以c(K+)>0.2mol/L;
故答案为:c(K+)>0.2mol/L.
点评 本题考查无机物的推断,把握常见离子的检验方法、离子反应及电荷守恒为解答的关键,侧重分析与推断、应用能力的考查,题目难度不大.

| A. | 制取一氯乙烷最好采用的方法是乙烷和氯化氢反应 | |
| B. | 化学平衡的标志之一是各物质的浓度相等 | |
| C. | C4H10的同分异构体有3种 | |
| D. | 乙烯能够使酸性高锰酸钾溶液褪色 |
①加成反应 ②取代反应 ③氧化反应.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
| a | |||||||
| b | c | d | |||||
| e | f | g |
(1)比较d、e元素常见离子的半径大小(用化学式表示)O2->Na+;
(2)b、c两元素非金属性较强的是(写元素符号)N,写出证明这一结论的一个化学方程式2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O.
(3)d、e元素形成的四原子化合物的电子式为
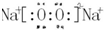 ;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”)
;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”) | A. | 稀硫酸滴在银片上:2Ag+2H+═2Ag++H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 硝酸银溶液与盐酸反应:Ag++Cl-═AgCl↓ | |
| D. | 澄清石灰水与碳酸钠溶液反应:Ca(OH)2+CO32-═CaCO3↓+2OH- |
 ,CCH2═CHCN.
,CCH2═CHCN.