题目内容
2.下列选项正确的是( )| A. | 制取一氯乙烷最好采用的方法是乙烷和氯化氢反应 | |
| B. | 化学平衡的标志之一是各物质的浓度相等 | |
| C. | C4H10的同分异构体有3种 | |
| D. | 乙烯能够使酸性高锰酸钾溶液褪色 |
分析 A.乙烷和氯化氢不反应;
B.达到平衡时,各物质的浓度不变;
C.C4H10的同分异构体有正丁烷和异丁烷2种;
D.乙烯可被酸性高锰酸钾氧化.
解答 解:A.乙烷和氯化氢不反应,可用乙烯与氯化氢发生加成反应制备,故A错误;
B.达到平衡时,各物质的浓度不变,但浓度不一定相等,故B错误;
C.C4H10的同分异构体有正丁烷和异丁烷2种,故C错误;
D.乙烯可被酸性高锰酸钾氧化,可使酸性高锰酸钾溶液褪色,故D正确.
故选D.
点评 本题综合考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,难度不大.

练习册系列答案
相关题目
10.下列说法不正确的是( )
| A. | 构成有机物的骨干元素是碳 | |
| B. | 构成地壳的骨干元素是Si,在二氧化硅晶体中每个Si原子周围结合4个O原子,每个O原子周围结台2个Si原子,[SiO4]四面体向空间无限伸展,形成立体网状结构 | |
| C. | 单质Si是制作计算机芯片的主要材料,SiO2是制取光导纤维的主要材料 | |
| D. | 空气中含量最大的元素是N.海水中含量最大的元索是C1,太阳系中含量最大的元素是H |
14.常温下,物质的量浓度相同的下列溶液中,符合pH由小到大顺序排列的是( )
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | B. | NaHCO3 Na2CO3 NH4Cl NaCl. | ||
| C. | NH4Cl (NH4)2SO4 Na2S NaNO3 | D. | (NH4)2SO4 NH4Cl NaNO3 NaHCO3 |
12.由几种离子化合物组成的混合物,含有以下离子中的若干种:
K+、Cl-、NH${\;}_{4}^{+}$、Mg2+、Ba2+、CO${\;}_{3}^{2-}$.、SO${\;}_{4}^{2-}$.
将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”);
(2)根据实验1~3判断原混合物中一定不存在的离子是Mg2+、Ba2+;
(3)若溶液中含有Cl-,则K+的物质的量应满足的条件是c(K+)>0.2mol/L.
K+、Cl-、NH${\;}_{4}^{+}$、Mg2+、Ba2+、CO${\;}_{3}^{2-}$.、SO${\;}_{4}^{2-}$.
将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
| 实验序号 | 实验内容 | 实验结果 |
| a | 加AgNO3溶液 | 有白色沉淀生成 |
| b | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积) |
| c | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27 g,第二次称量读数为2.33 g |
(1)根据实验1对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”);
(2)根据实验1~3判断原混合物中一定不存在的离子是Mg2+、Ba2+;
(3)若溶液中含有Cl-,则K+的物质的量应满足的条件是c(K+)>0.2mol/L.
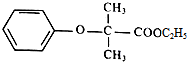
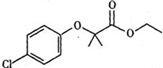 )是临床一种应用广泛的药物,它的一条合成路线如图:
)是临床一种应用广泛的药物,它的一条合成路线如图: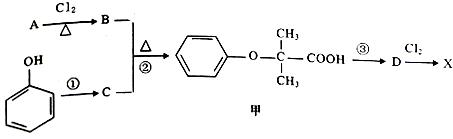
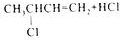
 .
.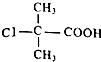 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$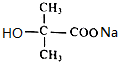 +NaCl+H2O.
+NaCl+H2O.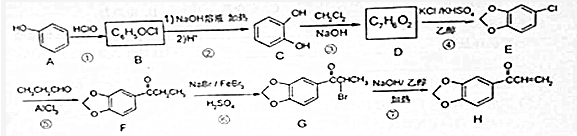
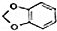 .
.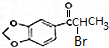 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaBr+H2O.
+NaBr+H2O. 等(写出其中一种的结构简式).
等(写出其中一种的结构简式). 的合成路线.
的合成路线.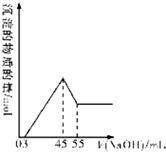 准确称取10.0g铝土矿样品(含Al2O3、Fe2O3、SiO2),加入100mL硫酸溶液,充分反应后向滤液中加入10mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积关系如图所示:
准确称取10.0g铝土矿样品(含Al2O3、Fe2O3、SiO2),加入100mL硫酸溶液,充分反应后向滤液中加入10mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积关系如图所示: CH3COOCH2CH3+H2O;苯制取环己烷:
CH3COOCH2CH3+H2O;苯制取环己烷: .
.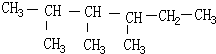 2,3,4-三甲基己烷,
2,3,4-三甲基己烷,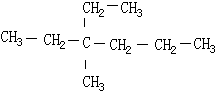 3-甲基-3-乙基己烷,
3-甲基-3-乙基己烷,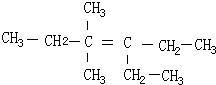 3,3-二甲基-4-乙基-3-己烯,
3,3-二甲基-4-乙基-3-己烯,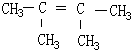 2,3-二甲基-2-丁烯.
2,3-二甲基-2-丁烯.