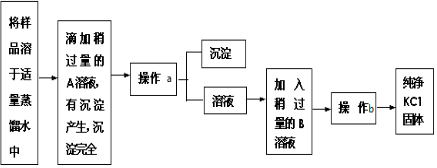
题目内容
9.下列有关化学用于正确的是( )| A. | KCl的摩尔质量是:74.5g | B. | 一水合氨的化学式为:NH4•OH | ||
| C. | Na2O2中的阴离子为:O2- | D. | 镁的原子结构示意图如图所示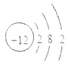 |
分析 A.摩尔质量是指单位物质的量的物质所具有的质量,摩尔质量的单位为g/mol;
B.一水合氨的化学式书写错误;
C.过氧化钠由2个钠离子与1个过氧根离子构成,阴离子过氧根离子书写错误;
D.原子结构示意图书写:圆内数字为原子的质子数,符号表示电性,圆外的弧线为电子层,弧线上的数字为该层上的电子数,离圆最近的弧线表示第一层,依次向外为第二层、第三层等.
解答 解:A.摩尔质量在数值上等于该物质的相对原子质量或相对分子质量,KCl的摩尔质量是:74.5g/mol,故A错误;
B.一水合氨的化学式为:NH3•H2O,故B错误;
C.Na2O2的电子式为 ,阴离子为O22-,故C错误;
,阴离子为O22-,故C错误;
D.镁原子的质子数为12,有3个电子层,第一电子层容纳2个电子,第二电子层容纳8个电子,最外层容纳2个电子,原子结构示意图为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了摩尔质量、一水合氨、Na2O2、原子结构示意图等知识,侧重基础知识的考查,注意化学用语的书写规范,题目难度不大.

练习册系列答案
相关题目
20.CaS可用于制备发光漆、用作脱毛剂、杀虫剂、硫脲等,还用于医药工业、重金属处理及环保中.某化学探究小组在实验室中利用反应:CaSO4+C$\stackrel{高温}{→}$CaS+CaO+SO2↑+CO↑+CO2↑制备硫化钙并检验产物,可选用的装置如下.回答下列问题:
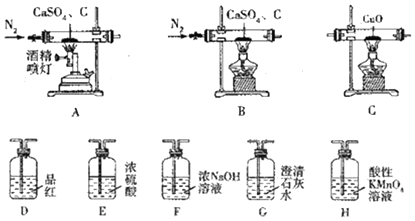
已知:①C及E~H中的试剂均为足量.
②酸性KMnO4溶液作氧化剂时,锰元素被还原成Mn2+
③CaS与H2O反应生成Ca(OH)2和H2S.
(1)实验1:若只检验生成物中是否含有CO,可采用的装置组合为AFECG(AFGECG或AFEC或AC)(按气流方向,填字母组合),生成物中存在CO的现象是装置C中黑色固体变为红色,装置G中澄清石灰水变浑浊.
(2)实验2:若只检验生成物中是否含有CO2,可釆用的最简单的装置组合为AHG(按气流方向,填字母组合),除去SO2的离子方程式为5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+.
(3)实验3:若同时检验CO2和SO2,采用的装置组合为ADHG或AHG(按气流方向,填字母组合).
(4)若制备反应的条件完全相同,将产生的气体全部通入上述实验装置中,得到的有关数据如表:
写出CaSO4和焦炭在高温条件下反应生成CaS的化学方程式:2CaSO4+3C$\frac{\underline{\;高温\;}}{\;}$CaS+CaO+SO2↑+2CO2↑+CO↑.
(5)为了证明硫化钙的化学式设计如下实验:将一定质量(m1)的样品溶于足量的饱和Na2CO3溶液中,通过过滤、洗涤、干燥操作,称得固体质量为m2,则表示硫化钙组成的计算式为n(Ca):n(S)=$\frac{{m}_{2}}{100}:\frac{5{m}_{1}-2{m}_{2}}{160}$(用含m1、m2的代数式表示).

已知:①C及E~H中的试剂均为足量.
②酸性KMnO4溶液作氧化剂时,锰元素被还原成Mn2+
③CaS与H2O反应生成Ca(OH)2和H2S.
(1)实验1:若只检验生成物中是否含有CO,可采用的装置组合为AFECG(AFGECG或AFEC或AC)(按气流方向,填字母组合),生成物中存在CO的现象是装置C中黑色固体变为红色,装置G中澄清石灰水变浑浊.
(2)实验2:若只检验生成物中是否含有CO2,可釆用的最简单的装置组合为AHG(按气流方向,填字母组合),除去SO2的离子方程式为5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+.
(3)实验3:若同时检验CO2和SO2,采用的装置组合为ADHG或AHG(按气流方向,填字母组合).
(4)若制备反应的条件完全相同,将产生的气体全部通入上述实验装置中,得到的有关数据如表:
| 实验前 | 实验后 | |
| 实验1 | 装置C硬质玻璃管连同CuO质量为26.80g | 装置C硬质玻璃管连同反应后固体质量为26.64g |
| 实验2 | 装置G连同溶液质量为187.50g | 装置G连同反应后溶液及沉淀的质量为188.38g |
| 实验3 | 装置D、H连同溶液质量和为373.60g | 装置D、H连同溶液质量和为374.24g |
(5)为了证明硫化钙的化学式设计如下实验:将一定质量(m1)的样品溶于足量的饱和Na2CO3溶液中,通过过滤、洗涤、干燥操作,称得固体质量为m2,则表示硫化钙组成的计算式为n(Ca):n(S)=$\frac{{m}_{2}}{100}:\frac{5{m}_{1}-2{m}_{2}}{160}$(用含m1、m2的代数式表示).
17.对于反应2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O的说法不正确的是( )
| A. | 该反应中,KMnO4是还原剂 | |
| B. | 该反应中,C元素被氧化 | |
| C. | 通过该反应可知,氧化性:KMnO4>CO2 | |
| D. | 该反应每转移1mol电子,同时生成1molCO2 |
4.将一固体粉末含有SiO2、Fe2O3、Al2O3,加入足量NaOH溶液充分反应后,过滤,向所得溶液中加入过量盐酸,过滤,将所得滤渣洗涤并灼烧至恒重,最终固体成份为( )
| A. | SiO2 | B. | Fe2O3、SiO2 | C. | SiO2、Al2O3 | D. | Fe2O3 |
14.用如图装置进行实验,将液体A逐滴加入到固体B中(必要时可加热),下列叙述错误的是( )


| A. | 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中产生白色沉淀,白色沉淀不会消失 | |
| B. | 实验仪器D可以起到防止溶液倒吸的作用 | |
| C. | 若A为浓盐酸,B为MnO2,C中盛石蕊溶液,则C中溶液先变红后褪色 | |
| D. | 若A为浓盐酸,B为贝壳,C中盛有硅酸钠溶液,则C中出现白色沉淀可证明酸性的强弱为:碳酸>硅酸 |

 .
. (要重新写过) 的合成路线:NCCH2CHO$→_{△}^{新制Cu(OH)_{2}}$ $\stackrel{H+}{→}$
(要重新写过) 的合成路线:NCCH2CHO$→_{△}^{新制Cu(OH)_{2}}$ $\stackrel{H+}{→}$ →
→ →
→ .
.