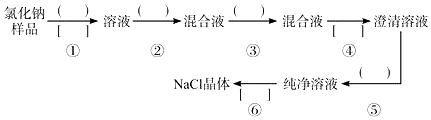
题目内容
18.KClO3是一种常见的氧化剂,常用于医药工业、印染工业和制造烟火.实验室用KClO3和MnO2混合加热制氧气,现取KClO3和MnO2混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g(25℃),再加5g水充分溶解,仍剩余固体4.80g(25℃).(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为11.80g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物(需提供必要计算步骤)
(a)求25℃时KCl的溶解度;
(b)求原混合物中KClO3的质量;
(c)所得KCl溶液的密度为1.72g/cm3,则溶液的物质的量浓度为多少?(保留2位小数)
分析 (1)若剩余的4.80g固体全是MnO2,m(KClO3)=16.60g-4.80g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物,则5g水溶解氯化钾得到的溶液是饱和溶液,据此计算其溶解度;反应前后质量减少的质量为氧气的质量,根据氯酸钾和氧气之间的关系式计算氯酸钾的质量;根据溶液质量、密度计算溶液体积,再结合c=$\frac{n}{V}$计算溶液的物质的量浓度;
解答 解:(1)若剩余的4.80g固体全是MnO2,m(KClO3)=16.60g-4.80g=11.80g,
故答案为:11.80;
(2)若剩余的4.80g固体是MnO2和KCl的混合物,则5g水溶解氯化钾得到的溶液是饱和溶液,5g水溶解KCl的质量=6.55g-4.80g=1.75g,
(a)则100g水溶解KCl的质量=$\frac{1.75g}{5g}$×100g=35g,答:25℃时KCl的溶解度35g;
(b)20g水溶解氯化钾的质量=1.75g×4=7g,反应前后质量减少的质量为氧气的质量,氧气的质量=16.60g-7g-4.80g=4.8g,根据氧原子守恒得$\frac{\frac{4.8g}{16g/mol}}{3}$×122.5g/mol=12.25,答:原混合物中KClO3的质量12.25g;
(c)溶液的质量=20g+7g=27g,溶液的体积=$\frac{27g}{1.72g/mL}$,n(KCl)=$\frac{7g}{74.5g/mol}$,则溶液的物质的量浓度=$\frac{\frac{7g}{74.5g/mol}}{\frac{27g}{1.72g/mL}}$=5.99mol/L,
答:溶液的物质的量浓度为5.99mol/L.
点评 本题考查了混合物的计算,涉及物质的量浓度的计算、溶解度的计算、物质间的反应等知识点,根据物质之间的关系式进行计算,注意结合原子守恒进行解答,题目难度中等.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案①v(A)=0.25mol/(L•s),
②v(B)=27mol/(L•min),
③v(C)=0.4mol/(L•s),
④v(D)=36mol/(L•min).
下列有关反应速率的比较中正确的是( )
| A. | ④>②>③>① | B. | ①>④>②>③ | C. | ①>②>③>④ | D. | ④>①>③>② |
| A. | KCl的摩尔质量是:74.5g | B. | 一水合氨的化学式为:NH4•OH | ||
| C. | Na2O2中的阴离子为:O2- | D. | 镁的原子结构示意图如图所示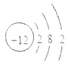 |
| A. | Ba(OH)2•8H2O与NH4Cl晶体混合 | B. | 盐酸与NaOH溶液混合 | ||
| C. | 炽热的碳与二氧化碳反应 | D. | Al片投入盐酸中 |
| A. | 0 | B. | 1 | C. | 2 | D. | 3 |