题目内容
下列有关平衡常数(K、Ka、Kw)的说法中错误的是( )
| A、各平衡常数的大小与温度有关 |
| B、若温度升高则各平衡常数一定增大 |
| C、平衡常数的大小能说明反应(或电离、溶解)进行的程度 |
| D、平衡常数越大反应(或电离)程度越大 |
考点:化学平衡常数的含义
专题:化学平衡专题
分析:平衡常数为温度的函数,只与温度有关,常数越大,反应的程度越大,因反应有吸热反应、放热反应,则升高温度,平衡常数不一定增大,以此解答该题.
解答:
解:A.平衡常数为温度的函数,只与温度有关,温度改变,则平衡常数一定改变,故A正确;
B.升高温度平衡向吸热反应方向移动,如果正反应是吸热反应,升高温度平衡常数增大,如果正反应是放热反应,升高温度平衡常数减小,故B错误;
C.化学平衡常数K=
,平衡常数越大,说明反应(或电离、溶解)进行的程度越大,故C正确;
D.由C可知,平衡常数越大反应(或电离)程度越大,故D正确.
故选B.
B.升高温度平衡向吸热反应方向移动,如果正反应是吸热反应,升高温度平衡常数增大,如果正反应是放热反应,升高温度平衡常数减小,故B错误;
C.化学平衡常数K=
| 生成物浓度幂的积 |
| 反应物浓度幂的积 |
D.由C可知,平衡常数越大反应(或电离)程度越大,故D正确.
故选B.
点评:本题考查了化学平衡常数的含义、影响因素,为高频考点,侧重于学生的分析能力的考查,明确化学平衡常数只与温度有关是解本题关键,题目难度不大.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
一定温度下,对可逆反应A(g)+2B(g)?3C(g)的下列叙述中,能说明反应已达到平衡的是( )
| A、A物质与B物质的反应速率之比为1:2 |
| B、单位时间内消耗a mol A,同时消耗3a mol C |
| C、容器内的压强不再变化 |
| D、混合气体的物质的量不再变化 |
某溶液中含有1.2×10-3mol XO3-,恰好能氧化30mL 0.1mol/L亚硫酸钠溶液,则还原产物中元素X的化合价是?( )
| A、0? | B、-2 | C、+1 | D、+2 |
 联合国气候变化大会于2010年12月召开,焦点议题之一是发展“低碳经济,节能减排”,减少温室气体排放.你认为下列做法中,不能有效减少空气中CO2含量的是( )
联合国气候变化大会于2010年12月召开,焦点议题之一是发展“低碳经济,节能减排”,减少温室气体排放.你认为下列做法中,不能有效减少空气中CO2含量的是( )| A、开发利用太阳能、风能、生物能、海洋能等清洁能源 |
| B、使用节能产品,推广节能环保汽车 |
| C、植树造林,增加森林植被面积 |
| D、用脱硫处理的煤代替原煤作燃料 |
与Ne核外电子排布相同的离子跟与Ar核外电子排布相同的离子形成的化合物是( )
| A、MgBr2 |
| B、Na2S |
| C、KCl |
| D、NaF |
盐酸能发生下列反应:①Zn+2HCl═ZnCl2+H2↑②2HCl+CuO═CuCl2+H2O ③MnO2+4HCl═MnCl2+Cl2↑+2H2O,因此盐酸具有的性质是( )
| A、只有酸性 |
| B、只有氧化性 |
| C、只有还原性 |
| D、以上三种均具有 |
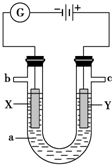 如图表示一个电解池,装有电解液a;X、Y是两块电极板通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板通过导线与直流电源相连.请回答以下问题: 对如图的解读不正确的是( )
对如图的解读不正确的是( )