题目内容
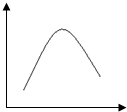 对如图的解读不正确的是( )
对如图的解读不正确的是( )| 选项 | 研究对象 | 横坐标 | 纵坐标 |
| A | 浓醋酸溶于水 | 加入水的量 | 导电能力 |
| B | A(g)?2B(g) | 压强 | 正反应速率 |
| C | 镁和稀盐酸反应 | 时间 | 反应速率 |
| D | 往密闭容器中通入 N2和H2发生反应: N2(g)+3H2(g)?2NH3(g)△H<0 | 温度 | NH3的体积分数 |
| A、A | B、B | C、C | D、D |
考点:弱电解质在水溶液中的电离平衡,化学反应速率的影响因素,化学平衡的影响因素
专题:图示题
分析:A.醋酸为弱电解质,加入促进电离;
B.增大压强,正逆反应速率都增大;
C.镁和盐酸为放热反应,注意浓度、温度对反应速率的影响;
D.升高温度,平衡逆向移动.
B.增大压强,正逆反应速率都增大;
C.镁和盐酸为放热反应,注意浓度、温度对反应速率的影响;
D.升高温度,平衡逆向移动.
解答:
解:A.醋酸为弱电解质,加入促进电离,开始时电离程度大于溶液体积的增大,浓度增大,当体积增大程度大于电离程度时,浓度反而减小,故A正确;
B.增大压强,正逆反应速率都增大,故B错误;
C.镁和盐酸为放热反应,开始温度升高,为主要因素,反应速率增大,当浓度较低时,速率减小,故C正确;
D.达到平衡时,升高温度,平衡逆向移动,NH3的体积分数先增大,后减小,故D正确.
故选B.
B.增大压强,正逆反应速率都增大,故B错误;
C.镁和盐酸为放热反应,开始温度升高,为主要因素,反应速率增大,当浓度较低时,速率减小,故C正确;
D.达到平衡时,升高温度,平衡逆向移动,NH3的体积分数先增大,后减小,故D正确.
故选B.
点评:本题考查较为综合,涉及电解质的电离、反应速率以及平衡移动等问题,为高考常见题型,侧重于学生的分析能力的考查,注意把握相关基础知识的积累,难度不大.

练习册系列答案
相关题目
铝不易被腐蚀,其主要原因是( )
| A、铝是一种轻金属 |
| B、铝的金属活动性比镁弱 |
| C、铝具有较高熔点 |
| D、铝易形成致密的氧化物薄膜 |
 实验室用MnO2与浓HCl反应制Cl2,若用如图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属镁粉的反应.每个虚线框表示一个单元装置,其中错误的是( )
实验室用MnO2与浓HCl反应制Cl2,若用如图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属镁粉的反应.每个虚线框表示一个单元装置,其中错误的是( )| A、只有①和②处 |
| B、只有②处 |
| C、只有①、②和③处 |
| D、①、②、③、④处 |
下列实验操作正确的是( )
A、 点燃酒精灯 |
B、 向溶液瓶中转移液体 |
C、 读取液体体积 |
D、 加热液体 |
下列糖类属于还原性糖的是( )
| A、蔗糖 | B、葡萄糖 |
| C、纤维素 | D、淀粉 |
下列有关平衡常数(K、Ka、Kw)的说法中错误的是( )
| A、各平衡常数的大小与温度有关 |
| B、若温度升高则各平衡常数一定增大 |
| C、平衡常数的大小能说明反应(或电离、溶解)进行的程度 |
| D、平衡常数越大反应(或电离)程度越大 |
在密闭容器中发生可逆反应4NH3+5O2?4NO+6H2O(g),以下是不同情况下的反应速率,其中最快的是( )
| A、v(O2)=0.01 mol?L-1?s-1 |
| B、v(NH3)=0.02 mol?L-1?s-1 |
| C、v(H2O)=0.04 mol?L-1?s-1 |
| D、v(NO)=0.03 mol?L-1?s-1 |
下列各组热化学方程式中,△H1>△H2的是( )
A、C(s)+O2(g)═CO2(g)△H1 C(s)+
| ||
| B、S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 | ||
C、2H2(g)+O2(g)═2H2O(l)△H1 H2(g)+
| ||
| D、CaCO3(s)═CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)═Ca(OH)2(s)△H2 |
 (1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是
(1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是