题目内容
13.下列事实不能用化学平衡移动原理解释的是( )| A. | 工业合成氨时使用催化剂 | |
| B. | 配制SnCl2溶液时加入一定量的盐酸 | |
| C. | 25℃时,在稀硫酸溶液中由水电离出的c(H+)<1×10-7mol/L | |
| D. | AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A、使用催化剂平衡不移动,故A不符合;
B、SnCl2是强酸弱碱盐,水解溶液呈酸性,所以加入一定量的盐酸起抑制作用,故B符合;
C、强酸和强碱对水的电离起抑制作用,所以由水电离出的c(H+)<1×10-7mol/L,故C符合;
D、同离子效应,氯化钠中氯离子对氯化银的溶解平衡起抑制作用,所以AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度,故D符合;
故选A.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意把握影响平衡移动的因素以及使用勒夏特列原理的前提.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
3.在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
| A. | 加入AgNO3后,再加稀硝酸酸化,有白色沉淀产生,说明有Cl- | |
| B. | 新制氯水使红玫瑰变为白玫瑰,说明有Cl2 | |
| C. | 将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO | |
| D. | 光照新制氯水有气泡逸出,该气体一定是Cl2 |
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L N2和H2混合气体中含N个原子 | |
| B. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| C. | 1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1N | |
| D. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2N |
1.鉴别苯酚溶液、已烯和甲苯,可选用的最佳试剂( )
| A. | 溴水 | B. | FeCl3溶液 | C. | 新制Cu(OH)2悬浊液 | D. | 酸性KMnO4溶液 |
8.化学与生活密切相关.下列说法中错误的是( )
| A. | 少量的硫磺和甲基苯酚都可以添加到肥皂中做消毒剂 | |
| B. | 可以通过煤的干馏得到苯、二甲苯等化工原料粗品 | |
| C. | 神州十一号航天员的航天服由碳化硅陶瓷和碳纤维复合制成,它是一种新型无机复合材料 | |
| D. | 经过一定化学变化,可以从海水中提取氯化钠或镁等 |
18.下列除去杂质的实验方法不正确的是( )
| A. | 除去Cl2中少量HC1气体:通过饱和食盐水后再干燥气体 | |
| B. | 除去Na2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去Fe(OH)3胶体中溶有的少量NaCl:加入适量水后过滤 | |
| D. | 除去CuCl2溶液中少量的FeCl3:加入稍过量的CuO后过滤 |
5.在某温度下,一密闭容器中模拟工业合成氨:N2(g)+3H2(g)?2NH3(g)△H<0;反应起始各物质的量如表:
达到平衡之后的 H2转化率α,NH3的体积分数为x%,下列说法错误的是( )
| N2 | H2 | NH3 | |
| 起始物质的量(mol) | 2 | 2 | 0 |
| A. | 平衡时NH3的物质的量:0mol<n(NH3)<$\frac{4}{3}$mol | |
| B. | 平衡时,N2的转化率为$\frac{α}{3}$ | |
| C. | 现将容器体积压缩到原来的一半,再次到达平衡之后,N2的体积分数变小 | |
| D. | 其他条件不变,若起始充入 N2、H2、NH3的物质的分别为:1.5mol、0.5mol、1mol,则到达平衡时,NH3的体积分数为x% |
2.Fe(OH)3可用来制颜料、药物,作净水剂.现设计实验研究制备Fe(OH)3的方法.
资料:新制Fe(OH)3在溶液中存在两种电离:Fe3++3OH-?Fe(OH)3?H++FeO2-+H2O
(1)向3支盛有1mL 1.0mol•L-1 FeCl3溶液的试管中,分别加入3mL不同浓度的NaOH溶液,都产生红褐色沉淀.充分反应后,过滤,取滤液分成两等份,分别进行实验,实验记录如表:
①产生红褐色沉淀的离子方程式是Fe3++3OH-?Fe(OH)3↓.
②当c(NaOH)≥6.0 mol•L-1时,实验Ⅱ中溶液变红的原因是FeO2-+4H+?Fe3++2H2O、Fe3++3SCN-?Fe(SCN)3(用离子方程式表示).
(2)有同学提出可用某些盐与FeCl3反应制备Fe(OH)3.
①向1mL 1.0mol•L-1 FeCl3溶液中滴加1.0mol•L-1Na2CO3溶液,立即有大量气泡并有红褐色沉淀产生.有同学提出沉淀中可能含有碳酸盐.将沉淀过滤、洗涤后取样,加入少量稀盐酸,有无色气体产生,证明沉淀中含有碳酸盐.
②向1mL 1.0mol•L-1FeCl3溶液中滴加1.0mol•L-1Na2SO3溶液,溶液由黄色变为红色,无丁达尔效应,继续滴加Na2SO3溶液,最终得到红褐色沉淀.经检验沉淀中除Fe(OH)3外还含有FeSO3.产生FeSO3的原因是2Fe3++SO32-+H2O?2Fe2++SO42-+2H+、Fe2++SO32-?FeSO3↓.
(3)比较(1)和(2),制备Fe(OH)3的合理方法是1mL1.0mol•L-1FeCl3溶液与3mL浓度小于6.0mol•L-1的NaOH溶液(注明试剂和用量).
(4)FeSO4溶液仅与一种试剂反应也可制Fe(OH)3,该试剂的化学式是NaClO(写出一种即可).
资料:新制Fe(OH)3在溶液中存在两种电离:Fe3++3OH-?Fe(OH)3?H++FeO2-+H2O
(1)向3支盛有1mL 1.0mol•L-1 FeCl3溶液的试管中,分别加入3mL不同浓度的NaOH溶液,都产生红褐色沉淀.充分反应后,过滤,取滤液分成两等份,分别进行实验,实验记录如表:
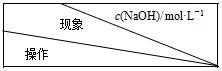 | 5.0 | 6.0 | 7.0 |
| 实验Ⅰ:滴入几滴KSCN溶液 | 不变红 | 不变红 | 不变红 |
| 实验Ⅱ:先加入过量稀硫酸,再滴入几滴KSCN溶液 | 不变红 | 变红 | 变红 |
②当c(NaOH)≥6.0 mol•L-1时,实验Ⅱ中溶液变红的原因是FeO2-+4H+?Fe3++2H2O、Fe3++3SCN-?Fe(SCN)3(用离子方程式表示).
(2)有同学提出可用某些盐与FeCl3反应制备Fe(OH)3.
①向1mL 1.0mol•L-1 FeCl3溶液中滴加1.0mol•L-1Na2CO3溶液,立即有大量气泡并有红褐色沉淀产生.有同学提出沉淀中可能含有碳酸盐.将沉淀过滤、洗涤后取样,加入少量稀盐酸,有无色气体产生,证明沉淀中含有碳酸盐.
②向1mL 1.0mol•L-1FeCl3溶液中滴加1.0mol•L-1Na2SO3溶液,溶液由黄色变为红色,无丁达尔效应,继续滴加Na2SO3溶液,最终得到红褐色沉淀.经检验沉淀中除Fe(OH)3外还含有FeSO3.产生FeSO3的原因是2Fe3++SO32-+H2O?2Fe2++SO42-+2H+、Fe2++SO32-?FeSO3↓.
(3)比较(1)和(2),制备Fe(OH)3的合理方法是1mL1.0mol•L-1FeCl3溶液与3mL浓度小于6.0mol•L-1的NaOH溶液(注明试剂和用量).
(4)FeSO4溶液仅与一种试剂反应也可制Fe(OH)3,该试剂的化学式是NaClO(写出一种即可).



