题目内容
9. “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,如溶液中的氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图所示:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,如溶液中的氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图所示:100t含FeS2质量分数为60%的硫铁矿原料在空气中氧化的总利用率为90%,该矿石最多可以制得硫酸铁120t.
分析 利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,由S原子守恒可知,存在3FeS2~2Fe2(SO4)3,以此计算.
解答 解:设该矿石最多可以制得硫酸铁为x t,则
3FeS2~2Fe2(SO4)3
360 800
100t×60%×90% x
$\frac{360}{100t×60%×90%}=\frac{800}{x}$,
解得x=120t,
故答案为:120.
点评 本题考查化学反应的计算,为高频考点,把握发生的反应及质量关系为解答的关键,侧重分析与计算能力的考查,注意利用原子守恒判断关系式,题目难度不大.

练习册系列答案
相关题目
4.关于有机物的结构、性质的叙述正确的是( )
| A. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| B. | 石油的主要成分是烃,煤经过分馏可制得焦炭、煤焦油等产品 | |
| C. | 丙烯分子中所有原子不可能在同一平面上 | |
| D. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 |
5.已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )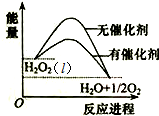

| A. | 加入催化剂,减小了反应的热效应(l) | |
| B. | 加入催化剂,不能提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2(l)═H2O(l)+$\frac{1}{2}$O2 (g)△H>0 | |
| D. | 无法比较反应物的总能量和生成物的总能量的相对大小 |
3.已知在25℃、101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水放出48.40kJ热量,表示上述反应的热化学方程式正确的是( )
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O△H=-48.40 kJ/mol | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5518 kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+5518 kJ/mol | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+48.40 kJ/mol |

 的系统命名4-甲基-2-乙基-1-戊烯
的系统命名4-甲基-2-乙基-1-戊烯 .
. .
. .
.