题目内容
17.在标准状况下15gCO与CO2的混合气体,集体为11.2L,则:(1)混合气体的密度是1.339g/L
(2)混合气体的平均摩尔质量是30g/mol.
(3)CO2和CO的体积之比是1:7.
(4)CO2和CO的质量之比是11:49.
(5)混合气体中所含碳原子的物质的量是0.5mol.
分析 (1)根据ρ=$\frac{m}{V}$计算混合气体的密度;
(2)根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,再根据M=$\frac{m}{n}$计算出平均摩尔质量;
(3)设CO与CO2的物质的量分别为xmol、ymol,根据二者质量及物质的量列方程解答;
(4)结合(3)中数据,根据m=nM计算CO2和CO的质量之比;
(5)根据质量守恒定律计算出混合物中含有碳原子的物质的量.
解答 解:在标准状况下15g CO与CO2的混合气体,体积为11.2L,
(1)混合气体的密度为:ρ=$\frac{15g}{11.2L}$=1.339g/L,
故答案为:1.339g/L;
(2)混合气体的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,混合气体平均摩尔质量为:$\frac{15g}{0.5mol}$=30g/mol,
故答案为:30g/mol;
(3)设CO与CO2的物质的量分别为xmol、ymol,根据二者质量及物质的量,则x+y=0.5、28x+44y=15,解得:x=$\frac{7}{16}$、y=$\frac{1}{16}$,故CO2和CO的体积之比是$\frac{1}{16}$mol:$\frac{7}{16}$mol=1:7,
故答案为:1:7;
(4)CO2和CO的质量之比为:($\frac{1}{16}$mol×44g/mol):($\frac{7}{16}$mol×28g/mol)=11:49,
故答案为:11:49;
(5)根据分子式CO、CO2可知,碳原子的物质的量与混合气体的物质的量相等,所以混合气体中碳原子的物质的量为0.5mol,
故答案为:0.5mol.
点评 本题考查物质的量的水解,题目难度中等,明确物质的量与摩尔质量等物理量之间的关系为解答关键,试题知识点较多、计算量较大,充分考查学生的分析能力及化学计算能力.

 名校课堂系列答案
名校课堂系列答案| A. | 1.8g的NH4+离子中含有的电子数0.1NA | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3 NA | |
| C. | 在常温常压下,11.2LCl2含有的分子数为0.5 NA | |
| D. | 标准状况下,11.2LH2O中含有的分子数目为0.5NA |
| A. | 8gH2 | B. | 48gO2 | C. | 71gCl2 | D. | 1000gH2O |
| A. | 大于C | B. | 小于C | C. | 等于C | D. | 不能确定 |
| A. | 一定温度和压强下,气体的体积主要由分子间的距离决定 | |
| B. | 通常状况下,气体摩尔体积约为22.4L | |
| C. | 标准状况下,气体摩尔体积约为22.4L | |
| D. | 单位物质的量的气体所占的体积就是气体摩尔体积 |
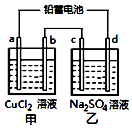 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42-+4e-=PbSO4+2H2O | |
| C. | 若四个电极材料均为石墨,当析出6.4gCu时,消耗H2SO40.2mol | |
| D. | 甲池中阳离子向b极移动 |

相关化合物的物理常数
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
(1)在反应器A中通入的X是氧气或空气.
(2)反应①和②分别在装置A和C中进行(填装置符号).
(3)在分解釜C中加入的Y为少置浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(4)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是可能会导致(过氧化物)爆炸.
(5)中和釜D中加入的Z最适宜的是c(填编号.已知苯酚是一种弱酸).
a.NaOHb.CaCO3c.NaHCO3d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.
 “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,如溶液中的氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图所示:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,如溶液中的氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图所示:
 x/m,该反应可用来检验Cr2O72-的存在.写出反应的离子方程式Cr2O72-+4H2O2+2H+=2CrO5+5H2O.
x/m,该反应可用来检验Cr2O72-的存在.写出反应的离子方程式Cr2O72-+4H2O2+2H+=2CrO5+5H2O.