题目内容
将密度为1.84g/cm3、质量分数为98%的浓硫酸稀释成1000mL、物质的量浓度为2mol/L的稀硫酸:
(1)该浓硫酸的物质的量浓度为 mol/L;
(2)所需该浓硫酸的体积为 mL.
(1)该浓硫酸的物质的量浓度为
(2)所需该浓硫酸的体积为
考点:物质的量的相关计算
专题:
分析:(1)根据c=
计算该浓硫酸的物质的量浓度;
(2)根据稀释定律,稀释前后溶质的物质的量不变,据此计算需要浓硫酸的体积.
| 1000ρω |
| M |
(2)根据稀释定律,稀释前后溶质的物质的量不变,据此计算需要浓硫酸的体积.
解答:
解:(1)密度为1.84g/cm3、质量分数为98%的浓硫酸的物质的量浓度为
mol/L=18.4mol/L,故答案为:18.4;
(2)设需要浓硫酸的体积为VmL,根据稀释定律,稀释前后溶质的物质的量不变,则:
VmL×18.4mol/L=1000mL×2mol/L
解得V=108.7
故答案为:108.7.
| 1000×1.84×98% |
| 98 |
(2)设需要浓硫酸的体积为VmL,根据稀释定律,稀释前后溶质的物质的量不变,则:
VmL×18.4mol/L=1000mL×2mol/L
解得V=108.7
故答案为:108.7.
点评:本题考查物质的量浓度有关计算,难度不大,注意理解掌握物质的量浓度与质量分数之间的关系.

练习册系列答案
相关题目
大气污染指( )
| A、大气中含有少量的有毒、有害的物质 |
| B、大气中有毒、有害的物质可以自净到正常值 |
| C、大气中某些有毒、有害物质的含量超过正常值或大气的自净能力 |
| D、空气中氮气的含量大于氧气的含量 |
下列离子反应方程式正确的是( )
| A、金属铁与稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ |
| B、NaHCO3与盐酸:HCO3-+H+=H2O+CO2↑ |
| C、碳酸钡与盐酸反应 CO32-+2H+═H2O+CO2↑+Ba2+ |
| D、醋酸与小苏打溶液反应H++HCO3-=CO2↑+H2O |
已知2Fe2++Br2=2Fe3++2Br-.向100mL的FeBr2溶液中通入标准状况下的Cl23.36L,充分反应后测得溶液中Cl-与Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )
| A、2 mol/L |
| B、1 mol/L |
| C、0.4 mol/L |
| D、0.2 mol/L |
甲烷和丙烷混合气的密度与同温同压下一氧化碳的密度相同,混合气中甲烷和丙烷的体积比是( )
| A、4:3 | B、3:4 |
| C、2:1 | D、1:1 |
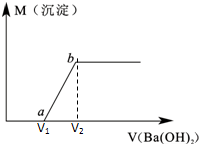 某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示.
某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示. 常温下,向25mL 0.1mol/LMOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(假设混合后溶液体积的微小变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/LMOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(假设混合后溶液体积的微小变化忽略不计).回答下列问题: