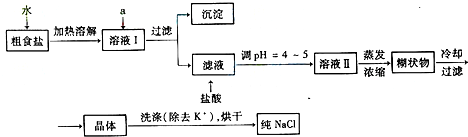
题目内容
甲烷和丙烷混合气的密度与同温同压下一氧化碳的密度相同,混合气中甲烷和丙烷的体积比是( )
| A、4:3 | B、3:4 |
| C、2:1 | D、1:1 |
考点:阿伏加德罗定律及推论
专题:
分析:甲烷和丙烷混合气的密度与同温同压下CO的密度相同,则甲烷与丙烷混合气体的平均相对分子质量与CO相等为28,设甲烷的体积分数为x,则丙烷的体积分数为1-x,根据平均相对分子质量列方程计算,据此解答.
解答:
解:甲烷和丙烷混合气的密度与同温同压下CO的密度相同,则甲烷与丙烷混合气体的平均相对分子质量与CO相等为28,
设甲烷的体积分数为x,则丙烷的体积分数为1-x,则:
=28,
解得x=
故混合气中甲烷和丙烷的体积比为x:(1-x)=
:
=4:3,
故选A.
设甲烷的体积分数为x,则丙烷的体积分数为1-x,则:
| 16x+44(1-x) |
| x+1-x |
解得x=
| 4 |
| 7 |
故混合气中甲烷和丙烷的体积比为x:(1-x)=
| 4 |
| 7 |
| 3 |
| 7 |
故选A.
点评:本题考查混合物的有关计算、阿伏伽德罗定律及推论,难度不大,理解平均相对分子质量的计算是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ?mol-1和2H2(g)+O2(g)═2H2O(g)△H=-484kJ?mol-1.则下列说法不正确的是( )
| A、CO转化为CO2的热化学方程式为2CO(g)+O2(g)═2CO2(g)△H=-566 kJ?mol-1 | ||
B、CO燃烧热的热化学方程式为CO(g)+
| ||
| C、放热反应可能需要加热才能进行,而吸热反应一定需要加热才能进行 | ||
| D、1mol H2完全燃烧生成1mol 液态水,放出的热量大于242 kJ |
下列中和反应对应的离子方程式能以“H++OH-═H2O”表示的是( )
| A、醋酸和氢氧化钠溶液反应 |
| B、氢氧化镁和盐酸反应 |
| C、澄清石灰水和硝酸反应 |
| D、氢氧化钡和稀硫酸反应 |
下列说法正确的是( )
| A、Al-Mg合金焊接过程中使用的保护气为N2 |
| B、工业上可采用电解熔融NaCl的方法制备金属钠 |
| C、将0.5molN2和1.5molH2充入一密闭容器中充分反应,放出热量19.6KJ,则该热化学方程式为N2(g)+3 H2(g)?2NH3(g)△H=-39.2 KJ?mol-1 |
| D、已知:2H2(g)+O2(g)?2H2O(g)△H=-486 KJ?mol-1,则H2的燃烧热△H为-243 KJ?mol-1 |