题目内容
11.甲溶液的pH=2,乙溶液的pH=4,甲溶液与乙溶液的c(H+)之比是( )| A. | 1:2 | B. | 2:1 | C. | 1:100 | D. | 100:1 |
分析 溶液pH的表达式为:pH=-lg[c(H+)],根据该表达式分别计算出pH=2、pH=4的溶液中氢离子浓度,然后计算出甲溶液与乙溶液的c(H+)之比.
解答 解:甲溶液的pH是2,溶液中c(H+)=10-2mol/L,
乙溶液的pH是4,溶液中的c(H+)=10-4mol/L,
则甲溶液与乙溶液的c(H+)之比为10-2mol/L:10-4mol/L=100:1,
故选D.
点评 本题考查pH的简单计算,为高频考点,题目难度不大,侧重于学生的分析能力和计算能力的考查,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的表达式.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| D. | 高纯度的硅单质用于制作光导纤维 |
19.下列离子方程式正确的是( )
| A. | 硝酸银与氯化钠溶液混合:AgNO3+Cl-═AgCl↓+NO3- | |
| B. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ | |
| C. | 氧化铜溶于稀硫酸:CuO+2H+═Cu2++H2O | |
| D. | NaHCO3溶液中滴加稀盐酸:2H++CO32-═H2O+CO2↑ |
6.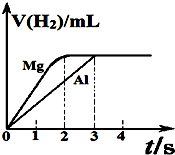 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)反应时间(t)的关系如图.则下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)反应时间(t)的关系如图.则下列说法正确的是( )
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)反应时间(t)的关系如图.则下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)反应时间(t)的关系如图.则下列说法正确的是( )| A. | 镁、铝消耗硫酸的物质的量之比为2:3 | |
| B. | 参加反应的镁、铝的质量之比为4:3 | |
| C. | 反应消耗镁、铝的摩尔质量之比为2:3 | |
| D. | 反应中镁、铝转移电子的物质的量之比为2:3 |
16.甲烷燃烧的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol,若以NA代表阿伏加德罗常数,则下列说法中正确的是( )
| A. | 有4NA个电子转移时,放出890 kJ的能量 | |
| B. | 有NA个C-H键断裂时,放出890 kJ的能量 | |
| C. | 有2NA个H2O(l)生成时,放出890 kJ的能量 | |
| D. | 有NA个C、O间的共用电子对生成时,放出890 kJ的能量 |
20.下列组合中,属于含有极性键的非极性分子的是( )
| A. | C2H4、C2H2、CO2 | B. | CH4、CHCl3、CO2 | C. | Cl2、H2、N2 | D. | NH3、H2O、CO2 |
1.下列关于反应热的说法正确的是( )
| A. | 当△H<0时,表示该反应为吸热反应 | |
| B. | 反应热与物质在反应时的状态有关 | |
| C. | 已知C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol | |
| D. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
 .
.