题目内容
19.下列离子方程式正确的是( )| A. | 硝酸银与氯化钠溶液混合:AgNO3+Cl-═AgCl↓+NO3- | |
| B. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ | |
| C. | 氧化铜溶于稀硫酸:CuO+2H+═Cu2++H2O | |
| D. | NaHCO3溶液中滴加稀盐酸:2H++CO32-═H2O+CO2↑ |
分析 A.硝酸银为易溶的强电解质,离子方程式中需要拆开;
B.漏掉了铵根离子与氢氧根离子的反应;
C.氧化铜与稀硫酸反应生成硫酸铜和水;
D.碳酸氢根离子不能拆开,需要保留整体形式.
解答 解:A.硝酸银与氯化钠溶液混合,反应生成氯化银沉淀和硝酸钠,硝酸银应该拆开,正确的离子方程式为:Ag++Cl-═AgCl↓,故A错误;
B.向硫酸铵溶液中加入氢氧化钡溶液,铵根离子也参与反应,正确的离子反应为:2NH4++2OH-+Ba2++SO42-═BaSO4↓+2NH3•H2O,故B错误;
C.氧化铜溶于稀硫酸的离子方程式为:CuO+2H+═Cu2++H2O,故C正确;
D.碳酸氢钠溶液中滴加稀盐酸,碳酸氢根离子不能拆开,正确的离子方程式为:H++HCO3-═H2O+CO2↑,故D错误;
故选C.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂.实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法不正确的是( )
| A. | ClO2是还原产物 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | 1molKClO3参加反应,转移电子物质的量为1mol | |
| D. | 生成5.6LCO2,转移的电子数目为0.25NA |
10.下列说法正确的是( )
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | 用加热的方法可除去KNO3溶液中混有的FeCl3 | |
| D. | Na2CO3溶液加水稀释后,恢复至室温,pH和Kw均减小 |
14.下列反应属于吸热反应的是( )
| A. | 石灰石在高温下的分解反应 | B. | 金属钠和水的反应 | ||
| C. | 盐酸与氢氧化钠溶液的反应 | D. | 木炭在氧气中燃烧 |
4.下列各组中离子在水溶液中能大量共存且满足相应要求的是( )
| 选项 | 离 子 | 要 求 |
| A | K+、NO3-、Cl-、SO42- | c(K+)<c(Cl-) |
| B | Ca2+、NO3-、CO32-、Cl- | 逐滴加入盐酸立即有气体产生 |
| C | Na+、Cu2+、Mg2+、SO42- | 逐滴加入NaOH溶液立即有沉淀产生 |
| D | H+、NH4+、Al3+、SO42- | 逐滴加入NaOH溶液立刻有气体产生 |
| A. | A | B. | B | C. | C | D. | D |
11.甲溶液的pH=2,乙溶液的pH=4,甲溶液与乙溶液的c(H+)之比是( )
| A. | 1:2 | B. | 2:1 | C. | 1:100 | D. | 100:1 |
8.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划.有关全氟丙烷的说法正确的是( )
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的电子式为: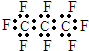 | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 一个全氟丙烷分子中有10个共用电子对 |
9.生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l)请完成以下实验设计表(表中不要留空格)
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示.

(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l)请完成以下实验设计表(表中不要留空格)
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |

(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |