题目内容
4.硫酸常用于金属表面除锈.(原理:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O)(1)把50g质量分数为98%的浓硫酸,稀释成10%的稀硫酸,需要水的质量是多少?
(2)要使16gFe2O3恰好完全反应,需消耗上述10%的稀硫酸的质量是多少?
分析 (1)溶液稀释前后溶质的质量不变,据此分析解答;
(2)据Fe2O3的质量和反应的方程式、溶质的质量=溶液的质量×溶质的质量分数,可计算出反应的稀硫酸的质量.
解答 解:(1)溶液稀释前后溶质的质量不变,设需水的质量为x,则有50g×98%=(50g+x)×10%,解得x=440g;
答:需要水的质量是440g;
(2)设需10%的稀硫酸的质量是y
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
160 294
16g y×10%
$\frac{160}{16g}$=$\frac{294}{y×10%}$
解得:y=294g
答:要使16g Fe2O3恰好完全反应,需消耗上述10%的稀硫酸的质量294g.
点评 本题考查了有关方程式的计算,题目难度不大,注意把握质量守恒定律在计算中的应用,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 标准状况下,2.24 L H2O中所含的原子总数为0.3NA | |
| B. | 0.1 molCl2与足量的NaOH稀溶液反应,转移的电子总数为0.2NA | |
| C. | 1mol•L一1的NaCl溶液中所含Na+数目为NA | |
| D. | 常温常压下,14g由N2和CO组成的混合气体中含有的原子总数为NA |
15.为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )
| 物质 | 试剂 | 分离方法 | |
| ① | 氯化钠(硝酸钾) | 蒸馏水 | 降温结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(苯酚) | 浓溴水 | 分液 |
| A. | ②③ | B. | ①③ | C. | 只有③ | D. | ③④ |
12.利用右图实验装置,能得出相应实验结论的是( )
| ① | ② | ③ | 实验结论 |  | |
| A. | 硫酸 | Na2SO3 | KMnO4 | SO2有漂白性 | |
| B. | Br2的苯溶液 | 铁屑 | AgNO3 | 苯和溴单质在铁催化剂作用下发生取代反应 | |
| C. | H2O | 工业电石 | KMnO4 | 乙炔具有还原性 | |
| D. | 硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
19.一定条件下,可逆反应2SO2(g)+O2(g)?2SO3(g)在某一密闭容器中进行,某一时刻测得c(SO2)=0.2mol/L c(O2)=0.15mol/L c(SO3)=0.2mol/L,反应一段时间,下列可能的是( )
| A. | c(SO2)=0.1mol/L | B. | c(O2)=0.05mol/L | C. | c(SO3)=0.5mol/L | D. | c(SO2)=0.4mol/L |
9.研究物质的物理性质时,最常用到的方法是( )
| A. | 观察 | B. | 实验 | C. | 假说 | D. | 模型 |
16.下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应生成盐和水的是( )
| A. | 元素X:它的原子中M层比L层少2个电子 | |
| B. | 元素Z:位于元素周期表中的第三周期第ⅢA 族 | |
| C. | 元素Y:它的二价阳离子核外电子总数与氩原子相同 | |
| D. | 元素W:它的焰色反应颜色呈紫色 |
13.将等物质的量的Na、Na2O、Na2O2、NaOH放入等质量的足量水中制成NaOH溶液,编号依次是甲、乙、丙、丁,所得的溶液中溶质的质量分数的说法正确的是( )
| A. | 甲=乙=丙=丁 | B. | 乙=丙>甲=丁 | C. | 乙>丙>甲>丁 | D. | 乙=丙>甲>丁 |
7.从柑橘中提取得到结构简式如图所示的化合物,则下列有关它的推断错误的是( )
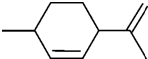

| A. | 属于芳香烃,分子式为C10H16 | B. | 常温下呈液态,比水轻 | ||
| C. | 其一氯代物有8种(不考虑顺反异构) | D. | 能与溴水发生加成反应 |