题目内容
6.下列说法正确的是( )| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | Na2O2中既含有离子键又含有非极性共价键 | |
| C. | KOH中只含有共价键 | |
| D. | KI和HI中化学键类型完全相同 |
分析 金属阳离子和阴离子之间的化学键为离子键,一般盐、碱金属氧化物中含有离子键,非金属元素之间的化学键为共价键,其中相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键,据此进行判断.
解答 解:A.含有共价键的化合物可能是离子化合物,也可能是共价化合物,如NaOH是离子化合物、HCl是共价化合物,故A错误;
B.Na2O2中钠离子与过氧根离子之间形成离子键,O原子之间形成非极性键,所以既含有离子键又含有非极性共价键,故B正确;
C.KOH中含有离子键和共价键,故C错误;
D.KI只含有离子键,HI只含有共价键,二者的化学键类型不相同,故D错误;
故选B.
点评 本题考查化学键和化合物的关系,侧重考查基本概念,把握物质的构成微粒及化学键的形成条件即可解答,注意离子键和共价键的区别,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
16.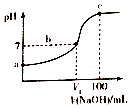 已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )
已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )
 已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )
已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )| A. | a点溶液的pH=4 | |
| B. | b点溶液中存在:c(A-)>c(Na+)>c(H+)=c(OH-) | |
| C. | b点c(HA)/c(A-)=5 | |
| D. | c点c(A-)+c(H+)=c(Na+)+c(OH-) |
17.下列4种有机物:
①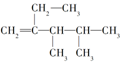
②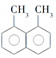
③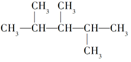
④
其中一氯取代物的同分异构体数目相同的是( )
①

②

③
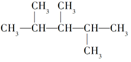
④

其中一氯取代物的同分异构体数目相同的是( )
| A. | ①和② | B. | ②和③ | C. | ①和③ | D. | ②和④ |
14.七水硫酸镁(MgSO4•7H2O)为白色细小四角柱状结晶,无臭,味苦,在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣一硼镁泥可制取七水硫酸镁.硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、CaO、B2O3、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
表2两种盐的溶解度(单位为g/100g水)
硼镁泥制取七水硫酸镁的工艺流程如图
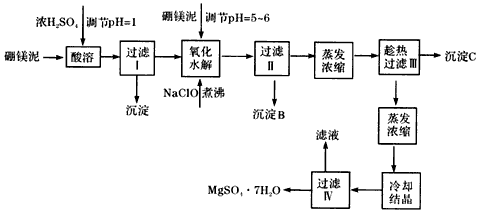
根据以上流程图并参考表格数据,试回答下列问题:
(1)在酸溶过程中,想加快酸溶速度,提出两种可行的措施加热,搅拌或将固体粉碎.
(2)沉淀A中除二氧化硅外,还含有硼酸(H3BO3),硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-
(3)经对沉淀B进行分析,发现其中含有二氧化锰,用离子方程式解释产生二氧化锰原因:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(4)加入硼镁泥调节pH=5~6目的是使溶液中的Al3+和Fe3+完全转化为沉淀而折出.
(5)得到的沉淀C的组成是CaSO4•2H2O或CaSO4(填化学式),过滤Ⅲ需趁热过滤,原因是趁热过滤有利于分离CaSO4和MgSO4并防止MgSO4在温度低时结晶析出
(6)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是取过滤Ⅱ后的溶液1~2ml丁试管中,加入少量KSCN溶液,如果溶液显红色,证明滤液中有Fe3+,否则无.
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | - |

根据以上流程图并参考表格数据,试回答下列问题:
(1)在酸溶过程中,想加快酸溶速度,提出两种可行的措施加热,搅拌或将固体粉碎.
(2)沉淀A中除二氧化硅外,还含有硼酸(H3BO3),硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-
(3)经对沉淀B进行分析,发现其中含有二氧化锰,用离子方程式解释产生二氧化锰原因:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(4)加入硼镁泥调节pH=5~6目的是使溶液中的Al3+和Fe3+完全转化为沉淀而折出.
(5)得到的沉淀C的组成是CaSO4•2H2O或CaSO4(填化学式),过滤Ⅲ需趁热过滤,原因是趁热过滤有利于分离CaSO4和MgSO4并防止MgSO4在温度低时结晶析出
(6)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是取过滤Ⅱ后的溶液1~2ml丁试管中,加入少量KSCN溶液,如果溶液显红色,证明滤液中有Fe3+,否则无.
1.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 氢氧化铝可作胃酸的中和剂 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属元素的化合物 | |
| C. | SiO2、NaOH、HF三者两两均能反应 | |
| D. | 制备单晶硅的过程中不发生氧化还原反应 |
11.在一定的温度下,向一个容积为2L的恒容密闭容器中(事先装入催化剂),充入2molN2和3molH2,3min后测得密闭容器内的压强是起始时的0.9倍.在这段时间内,用H2表示该反应的平均反应速率是( )
| A. | 0.125mol•L-1•min-1 | B. | 0.100 mol•L-1•s-1 | ||
| C. | 0.200 mol•L-1•min-1 | D. | 0.375 mol•L-1•s-1 |
18.下列各元素的氧化物中,既能与盐酸反应生成盐和水,又能与NaOH溶液反应生成盐和水的是( )
| A. | 元素X:位于元素周期表中的第三周期ⅢA 族 | |
| B. | 元素Y:它的二价阳离子核外电子总数与氖原子相同 | |
| C. | 元素Z:它的原子中M层比L层少2个电子 | |
| D. | 元素W:它的化合物的焰色反应颜色呈黄色 |
15.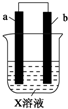 下列对如图所示装置实验现象的描述错误的是( )
下列对如图所示装置实验现象的描述错误的是( )
 下列对如图所示装置实验现象的描述错误的是( )
下列对如图所示装置实验现象的描述错误的是( ) | a电极 | b电极 | X溶液 | |
| ① | Cu | Zn | CuCl2 |
| ② | Zn | 石墨 | HCl |
| A. | 实验①中a极质量增加 | B. | 实验①中Cl-离子向正极移动 | ||
| C. | 实验②a极质量减少 | D. | 实验②中b极放出无色气体 |
12.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1 mol苯分子中含有碳碳双键数为3NA | |
| B. | 常温下,0.1 mol乙烷与乙烯混合气体中所含碳原子数为0.2NA | |
| C. | 14 g乙烯和丙烯的混合气体中所含原子总数为2NA | |
| D. | 标准状况下,22.4 L己烷中共价键数目为19NA |