题目内容
4.不能与Na2O2反应生成O2的是( )| A. | H2O | B. | CO | C. | CO2 | D. | 稀H2SO4 |
分析 A、Na2O2与H2O反应生成氢氧化钠和氧气;
B、Na2O2与CO不反应;
C、Na2O2与CO2反应生成碳酸钠和氧气;
D、Na2O2与稀H2SO4反应生成硫酸钠和氧气.
解答 解:A、Na2O2与H2O反应生成氢氧化钠和氧气,方程式为:2Na2O2+2H2O=4NaOH+O2↑,故A不选;
B、Na2O2与CO不反应,所以不能与Na2O2反应生成O2,故B选;
C、Na2O2与CO2反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2,故C不选;
D、Na2O2与稀H2SO4反应生成硫酸钠和氧气,方程式为:2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O,故D不选;
故选B.
点评 本题考查过氧化钠的性质,明确发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
14.有机物 在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )
在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )
 在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )
在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)( )| A. | 4 种 | B. | 5 种 | C. | 6 种 | D. | 7 种 |
15.25℃时,用浓度为0.1000mol/L的NaOH溶液分别滴定20.00mL浓度均为0.1000mol/L的两种酸HX、HY(忽略体积变化),实验数据如表,下列判断不正确的是( )
| 数据编号 | 滴入NaOH的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY | |
| B. | 由表中数据可估计出Ka(HX)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-) | |
| D. | 上述反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
12.某温度下,一反应平衡常数K=$\frac{{c}_{CO}×{c}_{{H}_{2}O}}{{c}_{C{O}_{2}}×{c}_{{H}_{2}}}$.恒容时到达平衡后,升高温度,H2浓度减小.下列说法正确的是( )
| A. | 升温,逆反应速率减小 | B. | 加压,H2浓度减小 | ||
| C. | 增加H2,K减小 | D. | 该反应的正反应是吸热反应 |
19.下列晶体中熔点最高的是( )
| A. | 食盐 | B. | 硫磺 | C. | 金刚石 | D. | 钨 |
16.茉莉酮可用作食用香精,其结构如图所示,下列关于其叙述正确的是( )
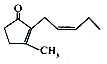

| A. | 茉莉酮易溶于水 | |
| B. | 茉莉酮中含有两种官能团 | |
| C. | 茉莉酮可与溴水、酸性KMnO4溶液发生加成反应,现象均为褪色 | |
| D. | 茉莉酮与二氢茉莉酮 互为同分异构体 互为同分异构体 |
13.36.96L(标准状况)的H2、D2、O2的混合气体点燃正好完全反应,生成20g的H2O、D2O、HDO组成的水,原混合物中的O2的质量是( )
| A. | 16g | B. | 17.6g | C. | 17.8g | D. | 18g |
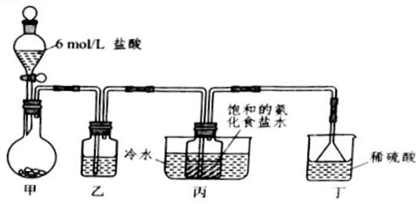
13.下列有关实验的叙述正确的是( )
| A. | 用分液漏斗分离乙醇和乙酸乙酯的混合物 | |
| B. | 新制氯水或浓硝酸存放在带橡皮塞的棕色玻璃瓶中 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 加热蒸发NaCl溶液时应用玻璃棒不断搅拌 |