题目内容
20.铁是日常生活中使用最广泛的金属.(1)高铁酸钾的化学式为K2FeO4,其中铁元索的化合价为+6.
(2)碳化铁(Fe3C)在冶金上称为渗碳体,在足量的空气中高温煅烧,生成有磁性的铁的氧化物和能使澄清石灰水变浑浊的气体,该反应的化学方程式为Fe3C+3O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+CO2,上述反应生成的磁性物质能溶于过量盐酸,该反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O.
(3)可用滴定法确定铁的某氯化物FeClx的化学式,实验中称取0.54g样品,用0.500mol•L-1的AgNO3标准液滴定,K2CrO4溶液为指示剂,到达终点时,共消耗AgNO3溶液19.94mL,则x=3;若滴定终点时,溶液中c(Ag+)=2.0×10-5mol•L-1,则c(CrO42-)=0.0028mol•L-1[已知:Ksp(Ag2CrO4)=1.12×10-12].
分析 (1)根据化合价代数和为0计算;
(2)Fe3C在足量的空气中高温煅烧生成四氧化三铁和二氧化碳;磁性固体能溶于过量盐酸发生反应生成氯化铁、氯化亚铁和水;
(3)由离子反应关系,银离子物质的量等于氯离子物质的量,据此计算0.54g FeClx中氯离子物质的量计算x值;根据Ksp(Ag2CrO4)=1.12×10-12计算c(CrO42-).
解答 解:(1)因为K2FeO4中化合价代数和为0,其中K为+1,O为-2,所以铁元索的化合价为+6,故答案为:+6;
(2)Fe3C在足量的空气中高温煅烧生成四氧化三铁和二氧化碳,反应为Fe3C+3O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+CO2;磁性固体能溶于过量盐酸发生反应生成氯化铁、氯化亚铁和水,离子反应为Fe3O4+8H+=2Fe3++Fe2++4H2O,
故答案为:Fe3C+3O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+CO2;Fe3O4+8H+=2Fe3++Fe2++4H2O;
(3)n(Cl-)=n(Ag+)=0.01994L×0.5 mol•L-1=0.01 mol,则$\frac{0.54g}{(56+35.5x)g/mol}$•x=0.010 mol,解得x=3;又Ksp(Ag2CrO4)=1.12×10-12,c(Ag+)=2.0×10-5mol•L-1,则c(CrO42-)=$\frac{1.12×10{\;}^{-12}}{(2.0×10{\;}^{-5}){\;}^{2}}$=0.0028mol•L-1,
故答案为:3;0.0028.
点评 本题考查滴定计算、混合物计算、方程式的书写等,难度中等,侧重分析能力与计算能力的综合考查.

| A. | Na2SO4[H2SO4] | B. | KBr[H2O] | C. | 盐酸[HCl] | D. | Cu(NO3)2[Cu(OH)2] |
| A. | 日常生活中常用75%的乙醇溶液来杀菌消毒 | |
| B. | 可用淀粉溶液来检测食盐中是否含碘 | |
| C. | 发酵粉中主要含有碳酸钠,能使焙制出的糕点疏松多孔 | |
| D. | 医院中常用碳酸钡作为内脏造影剂 |
| A. | 常温下,10g46%的CH3CH2OH溶液中所含有的氧原子数为0.4NA | |
| B. | 向FeI2溶液中通人适量的Cl2,当有1molFe2+被氧化时,共转移电子数目为3NA | |
| C. | 在标准状况下,将11.2LHCl溶于1L水中,溶液中HCl分子数为0.5NA | |
| D. | 常温常压下,0.1molNaHSO4晶体中,含有阴阳离子数共0.3NA |
| A. | 无色中性溶液中:Na+、K+、CO32-、SO42- | |
| B. | 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、I- | |
| C. | 加入铝粉后有气体放出的溶液:Fe2+、K+、NO3-、Cl- | |
| D. | 能使酚酞变红色的溶液:CO32-、Cl-、F-、K+ |
| A. | 水 | B. | 甲烷 | C. | 乙酸 | D. | 硫酸钠 |

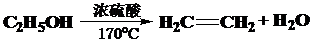 .
. .
.