题目内容
15.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温下,10g46%的CH3CH2OH溶液中所含有的氧原子数为0.4NA | |
| B. | 向FeI2溶液中通人适量的Cl2,当有1molFe2+被氧化时,共转移电子数目为3NA | |
| C. | 在标准状况下,将11.2LHCl溶于1L水中,溶液中HCl分子数为0.5NA | |
| D. | 常温常压下,0.1molNaHSO4晶体中,含有阴阳离子数共0.3NA |
分析 A.酒精溶液中除了酒精外,水也含氧原子;
B.根据碘离子和亚铁离子都能够被氯气氧化且先氧化碘离子再氧化亚铁离子分析;
C.氯化氢极易溶于水溶解后完全电离;
D.硫酸氢钠是由钠离子与硫酸氢根离子构成.
解答 解:A.10g46%的CH3CH2OH溶液中乙醇物质的量=$\frac{10g×46%}{46g/mol}$=0.1mol,酒精溶液中除了酒精外,水也含氧原子,水的物质的量=$\frac{10g×54%}{18g/mol}$=0.3mol,故溶液中的氧原子的个数0.4NA个,故A正确;
B.FeI2溶液中,碘离子的还原性大于亚铁离子的,通入适量氯气,当有1molFe2+被氧化时,溶液中碘离子已经完全被氧化,由于不知道碘化亚铁的物质的量,无法计算转移的电子数,故B错误;
C.氯化氢极易溶于水溶解后完全电离,不存在氯化氢分子,故C错误;
D..0.1 mol NaHSO4晶体中含0.1mol钠离子,0.1mol硫酸氢根离子,阴阳离子总数是0.2NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数,注意碘化亚铁中,碘离子的还原性大于亚铁离子的,通入氯气,先氧化碘离子再氧化亚铁离子,题目难度中等.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
6.下列对分子结构及其性质的解释中,不正确的是( )
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]属于手性分子,因分子中存在手性碳原子 | |
| C. | 配合物中一定含有过渡金属原子或离子,因为过渡金属原子或离子存在空轨道 | |
| D. | 酸性H3PO4>HClO,是因为H3PO4分子非羟基氧原子数目比HClO多 |
3. 原子序数依次增大的短周期元素A、B、C、D分别位于不同的主族,m、p、n分别是元素A、B、C的单质,D的单质可与热水发生置换反应;x、y、z是由A、B、C组成的二元化合物,其中y、z是气体,且z可用于配制碳酸饮料.它们之间有如图转化关系,下列说法正确的是( )
原子序数依次增大的短周期元素A、B、C、D分别位于不同的主族,m、p、n分别是元素A、B、C的单质,D的单质可与热水发生置换反应;x、y、z是由A、B、C组成的二元化合物,其中y、z是气体,且z可用于配制碳酸饮料.它们之间有如图转化关系,下列说法正确的是( )
 原子序数依次增大的短周期元素A、B、C、D分别位于不同的主族,m、p、n分别是元素A、B、C的单质,D的单质可与热水发生置换反应;x、y、z是由A、B、C组成的二元化合物,其中y、z是气体,且z可用于配制碳酸饮料.它们之间有如图转化关系,下列说法正确的是( )
原子序数依次增大的短周期元素A、B、C、D分别位于不同的主族,m、p、n分别是元素A、B、C的单质,D的单质可与热水发生置换反应;x、y、z是由A、B、C组成的二元化合物,其中y、z是气体,且z可用于配制碳酸饮料.它们之间有如图转化关系,下列说法正确的是( )| A. | D的单质起火燃烧时可用z作灭火剂 | B. | 元素的非金属性:C>A>B | ||
| C. | B、C与A形成化合物的沸点:C>B | D. | 原子半径:D>B>C>A |
10.下列反应属于置换反应的是( )
| A. | Fe+CuSO4═FeSO4+Cu | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | D. | NaOH+HCl═NaCl+H2O |
4.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | 人体缺乏铁元素,可以补充硫酸亚铁,且多多益善 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 |
3.设N0为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 0.5 摩1,3-丁二烯分子中含有共价键数为5.5N0 | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9N0 | |
| C. | 1 mol-OH和1 mol OH-所含电子数都为9N0 | |
| D. | 1 mol碳正离子(CH3+)所含的电子总数为8N0 |
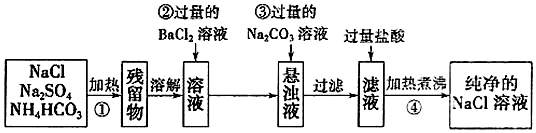
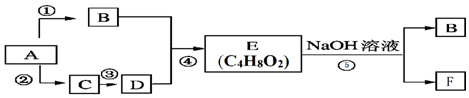

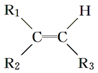 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$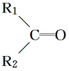 +R3COOH
+R3COOH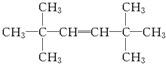 G:
G: .
.