题目内容
14.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与浓度和反应温度有关.下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,由于溶液浓度不同而能发生不同氧化还原反应的是( )| A. | ①③ | B. | ③④ | C. | ①② | D. | ①④ |
分析 ①Cu与浓硝酸反应生成二氧化氮,Cu与稀硝酸反应生成NO;
②Cu与FeCl3溶液,反应生成氯化亚铁、氯化铜;
③Zn与浓硫酸反应生成二氧化硫,Zn与稀硫酸反应生成氢气;
④Fe与HCl溶液,反应生成氯化亚铁和氢气.
解答 解:①③的反应均与酸的浓度有关,而②④的反应与浓度无关,
故选A.
点评 本题考查氧化还原反应,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
4.下列说法中正确的是( )
| A. | 同温同压下,气体的物质的量与体积成反比 | |
| B. | 同温同体积时,气体的物质的量与压强成反比 | |
| C. | 同温同物质的量时,气体的压强与体积成正比 | |
| D. | 同压同体积时,气体的物质的量与温度成反比 |
5.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
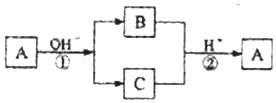

| A. | X元素可能为Al | B. | X元素可能为金属,也可能为非金属 | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②一定为氧化还原反应 |
2.下列说法正确的是( )
| A. | 20℃,1.01×105Pa下 11.2LN2含有的分子数为3.01×1023 | |
| B. | 4℃时9mL水和标准状况下11.2L氮气含有相同的分子数 | |
| C. | 同温同压下,lmol NO与lmol N2和O2的混合气体的体积不相等 | |
| D. | 0℃、1.01×10sPa时,11.2L氧气所含的原子数目为3.01×1023 |
9.下列说法正确的是( )
| A. | 标准状况下,20mL NH3跟60mL O2所含的分子个数比为1:3 | |
| B. | 22.4L O2中一定含有6.02×1023个氧分子 | |
| C. | 将80克NaOH溶于1L水中,所得溶液的物质的量浓度为2mol/L | |
| D. | 18克H2O在标准状况下的体积为0.018L |
19.有机物分子 中,最多可有多少个原子共平面( )
中,最多可有多少个原子共平面( )
 中,最多可有多少个原子共平面( )
中,最多可有多少个原子共平面( )| A. | 20 | B. | 19 | C. | 22 | D. | 21 |
4.硫酸锌可用于制造锌钡白、印染媒染剂等.用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4•7H2O的流程如图.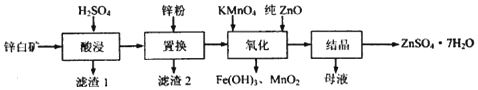
相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如表:
(1)“滤渣1”的主要成分为SiO2(填化学式).“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度粉碎锌白矿(或充分搅拌浆料、适当加热等)(填一种).
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为Zn+CuSO4═Cu+ZnSO4.
(3)“氧化”一步中,发生反应的离子方程式为3Fe2++MnO4-+7ZnO+9H+═3Fe(OH)3+MnO2+7Zn2+.溶液PH控制在[3.2,6.4)之间的目的是使Fe3+沉淀完全,而Zn2+不沉淀MnO4-变为MnO2沉淀,避免引入杂质.
(4)“母液”中含有的盐类物质有ZnSO4、K2SO4(填化学式).

相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 6.4 | 8.0 |
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为Zn+CuSO4═Cu+ZnSO4.
(3)“氧化”一步中,发生反应的离子方程式为3Fe2++MnO4-+7ZnO+9H+═3Fe(OH)3+MnO2+7Zn2+.溶液PH控制在[3.2,6.4)之间的目的是使Fe3+沉淀完全,而Zn2+不沉淀MnO4-变为MnO2沉淀,避免引入杂质.
(4)“母液”中含有的盐类物质有ZnSO4、K2SO4(填化学式).