题目内容
4.如图为某可逆反应反应体系的能量随反应进程的变化曲线,有关说法正确的是( )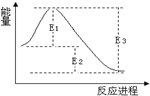
| A. | 该反应常温下一定可以自发进行 | |
| B. | 使用催化剂可以改变E1、E2、E3的大小,从而改变正逆反应速率 | |
| C. | E2为该反应的焓变,且该反应的△H<0 | |
| D. | 该反应反应物能量大于生成物能量,故可设计成原电池 |
分析 A.该反应为放热反应,△G=△H-T•△S<0反应自发进行;
B.使用催化剂可以改变反应的活化能,不能改变焓变;
C.E2为该反应的焓变,△H=E1-E3<0;
D.自发的氧化还原反应可以设计成原电池.
解答 解:A.该反应为放热反应,△H<0,只有满足常温下△G=△H-T•△S<0,反应才能自发进行,故A错误;B.使用催化剂可以改变E1、E3的大小,不能改变E2的大小,故B错误;
C.E2为该反应的焓变,△H=E1-E3<0,故C正确;
D.该反应不一定是自发的氧化还原反应,因此不一定可设计成原电池,故D错误;
故选C.
点评 本题涉及化学反应自发性、物质的能量和反应的吸放热之间的关系、催化剂的特点、原电池原理等知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
15.分子式为C5H10O2,即能和金属钠反应,又能发生银镜反应的有机化合物有多少种(不考虑立体异构)( )
| A. | 10 | B. | 11 | C. | 12 | D. | 13 |
19.下列有机物结构与性质分析正确的是( )
| A. |  与 与 是同系物 是同系物 | |
| B. | 乙酸乙酯(CH3COOCH2CH3)的核磁共振氢谱出现三组峰,且峰面积之比为3:2:3 | |
| C. | 分子式为C4H10的有机物一氯代物共有8种 | |
| D. |  含氧官能团有4种 含氧官能团有4种 |
16.VLAl2(SO4)3溶液中含agAl3+,从中取出$\frac{V}{2}L$,并稀释至VL,则稀释后SO42-的物质的量浓度为( )
| A. | $\frac{a}{36V}$mol/L | B. | $\frac{a}{18V}$mol/L | C. | $\frac{a}{54V}$mol/L | D. | $\frac{a}{27V}$mol/L |
14.某有机化合物的结构简式如图: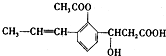 ,下列有关该有机化合物的说法不正确的是
,下列有关该有机化合物的说法不正确的是
( )
 ,下列有关该有机化合物的说法不正确的是
,下列有关该有机化合物的说法不正确的是( )
| A. | 含有四种官能团 | |
| B. | 能发生取代、加成、消去、氧化等反应• | |
| C. | 1mol该有机物最多可以与2molNaOH反应 | |
| D. | 该有机物属于芳香族化合物 |
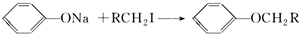
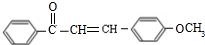 (不要求立体异构).
(不要求立体异构).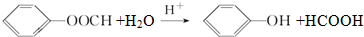 .
.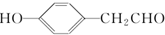 (写结构简式).
(写结构简式). 在人类社会的发展进程中,金属起着重要的作用.
在人类社会的发展进程中,金属起着重要的作用.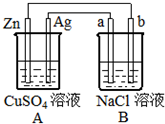 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.