题目内容
9.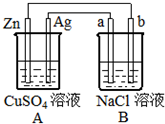 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.(1)判断装置的名称:A为原电池,
(2)A装置中,Ag电极的电极反应式为:Cu2++2e-=Cu,
(3)B装置中的电极b极为电极反应式为2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-),
B装置中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(4)一段时间后,当Zn片质量减少6.5g时,b极生成的气体在标准状况下的体积2.24L,CuSO4溶液的质量增加(填“增加”或“减少”)了0.1 g.
(5)一段时间后,当Zn片质量减少29.25g时,a极生成的气体的物质的量为31.95g.
分析 由装置图可知,A为锌、银原电池,锌为负极,银为正极,负极发生氧化反应,正极发生还原反应,电极方程式为Cu2++2e-═Cu,B为电解池装置,其中a为阳极,发生氧化反应,b为阴极,发生还原反应,结合电极方程式解答该题.
解答 解:(1)A为原电池,故答案为:原电池;
(2)Ag为正极,发生还原反应,电极反应式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(3)B为电解池,b连接原电池负极,为电解池的阴极,电极方程式为2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-),为电解食盐水装置,总方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-);2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(4)工作一段时间后,当Zn片质量减少6.5g时,即0.1mol,则转移电子0.2mol,b极发生2H--2e-=H2↑,可生成0.1molH2,标准状况下的体积为2.24L,生成铜0.1mol,所以铜质量为:6.4g,所以CuSO4溶液的质量增加0.1g;
故答案为:2.24;增加;0.1;
(5)工作一段时间后,当Zn片质量减少29.25g时,即0.45mol,则转移电子0.9mol,a极发生2Cl--2e-=Cl2↑,可生成0.45molCl2,气体的质量为:0.45mol×71g/mol=31.95g,故答案为:31.95g.
点评 本题考查原电池和电解池原理,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握原电池和电解池的工作原理,把握电极方程式的书写,难度不大.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | 氯气 | B. | 氯化镁 | C. | 溴化钠 | D. | 水 |
| A. | K+、Na+、MnO4-、SO42- | |
| B. | I-、Na+、NO3-、ClO- | |
| C. | Mg2+、Na+、NO3-、SO42- | |
| D. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ |
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离的c(H+)=1×10-13mol/L溶液中:K+、Na+、AlO2-、CO32- | |
| D. | 含1.0mol•L-1Al3+的溶液中:Na+、HCO3-、SO42-、Mg2+ |
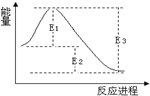
| A. | 该反应常温下一定可以自发进行 | |
| B. | 使用催化剂可以改变E1、E2、E3的大小,从而改变正逆反应速率 | |
| C. | E2为该反应的焓变,且该反应的△H<0 | |
| D. | 该反应反应物能量大于生成物能量,故可设计成原电池 |
| A. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| B. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| C. | 浓硫酸不慎滴到皮肤上,先用较多的水冲洗,再涂上3%~5%的碳酸氢钠溶液 | |
| D. | 除去粗盐中的硫酸盐应加入BaCl2溶液,离子反应为Ba2++SO42-═BaSO4↓ |
| A. | 各能层含有电子数为2n2 | |
| B. | 各能层的能级都是从s能级开始至f能级结束 | |
| C. | 各能层含有的能级数为n-l | |
| D. | 各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7 |
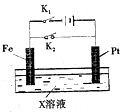 如图是一个电化学过程的示意图,请回答下列问题:
如图是一个电化学过程的示意图,请回答下列问题: