题目内容
6.硫磺可用于生产化工原料硫酸,某工厂用图所示的工艺流程生产硫酸: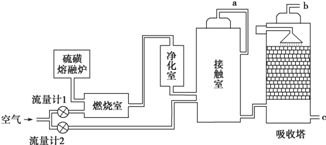
请回答下列问题:
(1)为了充分利用反应放出的热量,接触室中应安装热交换器(填设备名称).吸收塔中填充有许多瓷管,其作用是增加SO3与浓硫酸的接触面积,有利于SO3的吸收.
(2)吸收塔中用浓硫酸(填物质名称)吸收SO3,理由是:防止形成酸雾,提高SO3的吸收率.
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是C.
A.产生的废渣多B.二氧化硫的转化率提高 C.耗氧量减少D.不需要使用催化剂
(4)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、SO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSO3、2CaSO3+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4,或(2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2).
(5)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2倍,则生产过程中流经流量计1和流量计2的空气体积比应为1.5:1或3:2.假设接触室中SO2的转化率为90%,生成的SO3能够被完全吸收,b管排出的尾气中二氧化硫的体积分数为0.9%或0.009(保留1位有效数字,空气中氧气的体积分数按0.2计),该尾气的处理方法是用氨水吸收(用氢氧化钠等强碱性溶液吸收也可以).
分析 (1)接触室中热交换器的主要作用是预热未反应的气体和冷却反应后的气体,可节省能源,充分利用能量,应安装热交换器;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收;
(2)在吸收塔中若直接用水吸收三氧化硫,三氧化硫与水反应生成硫酸,会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收;
(3)A.用硫铁矿为原料产生的废渣较多,但废气量相同;
B.原料选择与SO2的转化率无关;
C.硫铁矿中铁的氧化需要消耗O2;
D.用SO2制取SO3的过程中都需要使用催化剂;
(4)CaCO3高温分解生成CO2和CaO,SO2为酸性氧化物,可以和碱性氧化物CaO反应生成CaSO3,而CaSO3易被氧化为CaSO4;
(5)假设SO2的体积为x,经流量计1通入燃烧室的氧气过量50%,则流量计1中通入氧气的体积为1.5x,经流量计2的氧气量为接触室中SO2完全氧化时理论需氧量的2倍,则流量计2中通入氧气的体积为2×0.5x=x,据此分析解答;二氧化硫污染空气,应用碱液吸收.
解答 解:(1)SO2与O2的反应为放热反应,为了充分利用能量,应安装热交换器;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收,
故答案为:热交换器;增加SO3与浓硫酸的接触面积,有利于SO3的吸收;
(2)在吸收塔中生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,防止形成酸雾,提高SO3的吸收率;
故答案为:防止形成酸雾,提高SO3的吸收率;
(3)用硫铁矿为原料产生的废渣较多,但废气量相同,故A项错误;原料选择与SO2的转化率无关,故B项错误;硫铁矿中铁的氧化需要消耗O2,所以硫耗氧少些,故C项正确;用SO2制取SO3的过程中都需要使用催化剂,故D项错误,
故选:C;
(4)CaCO3高温分解生成CO2和CaO,SO2为酸性氧化物,可以和碱性氧化物CaO反应生成CaSO3,而CaSO3易被氧化为CaSO4,
所以发生反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ SO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSO3 2CaSO3+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4,或(2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2);
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、SO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSO3、2CaSO3+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4,或(2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2);
(5)燃烧室中的反应为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,假设SO2的体积为x,则流量计1中通入氧气的体积为1.5x,接触室中的反应为2SO2+O2$?_{△}^{催化剂}$2SO3,那么二氧化硫完全氧化时理论需氧量为$\frac{x}{2}$,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2倍,所以流量计2中通入氧气的体积为x;因为氧气占空气的$\frac{1}{5}$(即0.2),所以流量计1中通入空气的体积为:1.5x÷$\frac{1}{5}$=7.5x,流量计2中通入空气的体积为:x÷$\frac{1}{5}$=5x,故流经流量计1和流量计2的空气体积比应为7.5x:5x=3:2;燃烧室剩余空气6.5x,接触室剩余空气5x-$\frac{x}{2}$=4.5x,SO2的转化率为90%,所以剩余SO2为0.1x,故b管尾气中SO2的体积分数为:$\frac{0.1x}{6.5x+4.5x}$=0.9%;SO2为酸性氧化物,可以用碱液(如氨水)吸收;
故答案为:1.5:1或3:2;0.9%或0.009; 氨水(用氢氧化钠等强碱性溶液吸收也可以).
点评 本题是对化学与技术及工业生产的考查,需要学生细读生产工艺图中各物质的变化进行解答,把握氨碱法、制备浓硫酸的工艺流程及设备的作用、发生的化学反应为解答的关键,题目难度中等.

| A. | 洪灾区民众用明矾净水并用漂白粉消毒,二者化学原理相同 | |
| B. | 燃煤发电厂在煤燃烧时加入一些生石灰,能减少废气中的二氧化硫排放 | |
| C. | 洗涤脱排油烟机表面的油脂污物时,热的纯碱溶液比冷的去污效果好 | |
| D. | 通讯领域中的光导纤维不可长期浸泡在强碱性溶液中 |
| A. | 三种溶液中c(Cl-)的关系是①=②=③ | |
| B. | 若将三种溶液稀释相同的倍数,pH变化最小的是② | |
| C. | 三种溶液中由水电离出的c(H+)的关系是①<②<③ | |
| D. | 若向三种溶液中分别加入20mL0.1mol•L-1的NaOH溶液后,pH最小的是③ |
| A. | 硫酸工业的尾气中含有少量SO2,可用石灰水吸收,然后再用硫酸处理 | |
| B. | 工业上,常采用铁触媒催化剂,在400~500℃和10~30 MPa的条件下合成氨 | |
| C. | 造气中产生的CO,可在催化剂作用下,与水蒸气反应生成CO2和H2. | |
| D. | 在硫酸生产中,SO2催化氧化选择1~10 MPa、400~500℃条件下进行 |
 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).Ⅰ.实验步骤
(1)用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
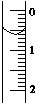
(3)读取盛装0.100 0mol•L-1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,
停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)按实验所得数据,可得c(市售白醋)=0.75mol•L-1(列式计算);市售白醋总酸量=4.5g•100mL-1(列式计算).
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.

 ;
;