题目内容
1.下列说法不符合生产实际的是( )| A. | 硫酸工业的尾气中含有少量SO2,可用石灰水吸收,然后再用硫酸处理 | |
| B. | 工业上,常采用铁触媒催化剂,在400~500℃和10~30 MPa的条件下合成氨 | |
| C. | 造气中产生的CO,可在催化剂作用下,与水蒸气反应生成CO2和H2. | |
| D. | 在硫酸生产中,SO2催化氧化选择1~10 MPa、400~500℃条件下进行 |
分析 A.二氧化硫是污染气体用石灰水吸收生成亚硫酸钙;硫酸处理得到高浓度的SO2,可以循环使用;
B.氮气和氢气在催化剂作用下高温高压合成氨;
C.一氧化碳和水蒸气反应生成二氧化碳和氢气,作为合成氨的原料气制备;
D.二氧化硫的催化氧化反应在常压下转化率已经很高,加压变化不大.
解答 解:A.二氧化硫是污染气体用石灰水吸收生成亚硫酸钙;硫酸处理得到高浓度的SO2,可以循环使用,故A正确;
B.氮气和氢气在催化剂作用下高温高压合成氨,在400~500℃时催化剂活性最大,提高反应速率,反应是气体体积减小的反应,加压平衡正向进行,故B正确;
C.一氧化碳和水蒸气反应生成二氧化碳和氢气,作为合成氨的原料气制备,故C正确;
D.二氧化硫的催化氧化反应在常压下转化率已经很高,加压变化不大,且对设备要求较高,成本增大;400~500℃条件下催化剂活性最大,可以提高反应速率,故D错误;
故选D.
点评 本题考查了工业制硫酸的工业流程和注意问题,反应的条件选择,工业合成氨的生产条件选择和原料气的制备,掌握工业生产流程是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列图示与对应的叙述相符的是( )


| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图丁表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则aHCl表示溶液 |
8.分别进行如下表所示实验,现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 稀硝酸不能将Fe氧化为Fe3+ |
| B | NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-与HCO3-发生双水解反应 |
| C | 向某溶液里滴加稀NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变 | 原溶液中无NH4+ |
| D | 将0.1mol•L-1MgSO4溶液滴入到NaOH溶液里至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成,后变为蓝色沉淀 | Cu(OH)2的Ksp比Mg(OH)2的Ksp小 |
| A. | A | B. | B | C. | C | D. | D |
10.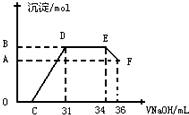 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
I.该同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.请你设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应反应产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为:H++OH-═H2O.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:NH4++OH-═NH3•H2O.
(3)当图中C=13mL时,原溶液中Fe3+与Al3+的物质的量之比为2:1.
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应反应产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为:H++OH-═H2O.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:NH4++OH-═NH3•H2O.
(3)当图中C=13mL时,原溶液中Fe3+与Al3+的物质的量之比为2:1.
11.某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系).
请你帮助该同学整理并完成实验报告.
(1)实验目的:研究同周期元素性质的递变规律
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等.
仪器:①试管,②酒精灯,③烧杯,试管夹,镊子,小刀,玻璃片,砂纸,火柴等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和③、⑥的反应方程式)
实验步骤③涉及的化学方程式2Na+2H2O═2NaOH+H2↑,实验步骤 ⑥涉及的离子方程式Al3++4OH-=AlO2-+2H2O.
(4)实验结论:同一周期,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强.
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
(1)实验目的:研究同周期元素性质的递变规律
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等.
仪器:①试管,②酒精灯,③烧杯,试管夹,镊子,小刀,玻璃片,砂纸,火柴等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和③、⑥的反应方程式)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A-F) |
(4)实验结论:同一周期,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强.

 2SO3.
2SO3.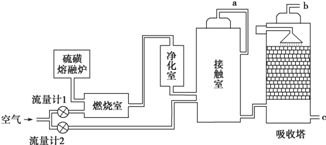
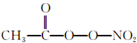 (PAN)等二次污染物.
(PAN)等二次污染物.