题目内容
7.某化学研究性学习小组为了模拟工业从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性.设计了如下操作步骤及主要实验装置如图1夹持装置略去):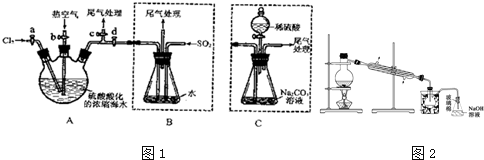
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入氯气至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴.
(1)实验室制备氯气的化学方程式为MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)步骤②中鼓入热空气的作用是使A中生成的Br2随空气流进入B中;
(3)装置 B中发生的主要反应的离子方程式为.
(4)此实验中尾气可用c(填选项字母)吸收处理.
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCl溶液
(5)步骤⑤中,用图2所示装置进行蒸馏,收集液溴,装置图中缺少的必要仪是温度计、水浴;
(6)若直接连接A与C.首先关闭活塞b、d,打开活塞a、c,向A中缓慢通入氯气至反应结束;然后关闭a、c,打开b、d,向A中鼓入足量热空气;充分反应后,向锥形瓶中滴加稀硫酸;再将C中所得液体进行蒸馏收集液溴,也能制得液溴.滴加稀硫酸之前C中反应生成了NaBrO3等,该反应的化学方程式为3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑.
(7)与B装置相比,采用C装置的优点为操作简单,污染小.
分析 (1)实验室制备氯气的反应为二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(2)溴易挥发,步骤②中鼓入热空气把A中生成的溴蒸气排出到B中;
(3)二氧化硫具有还原性,把单质溴还原为溴离子;
(4)溴、氯气和二氧化硫都有毒,可用碱液吸收;
(5)根据蒸馏所需仪器回答;由于题干中给出信息Br2的沸点是59℃,提纯溴必须收集59℃时的馏分,所以控制温度得到馏分是关键;
(6)根据题给信息,溴和碳酸钠反应生成了溴化钠和溴酸钠,化合价升降总数相等和原子守恒配平方程式;
(7)采用C装置,步骤少,减少了二氧化硫的污染.
解答 解:(1)实验室制备氯气的反应为二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br2,
故答案为:使A中生成的Br2随空气流进入B中;
(3)二氧化硫具有还原性,把单质溴还原为溴离子,反应的方程式为Br2+SO2+2H2O═4H++2Br-+SO42-;
故答案为:Br2+SO2+2H2O═4H++2Br-+SO42-;
(4)氯气不可能完全反应,氯气和溴离子反应生成溴单质,未反应的二氧化硫、氯气和溴都有毒,不能直接排空,且这几种物质都能和碱反应,所以用碱液吸收;
故答案为:c;
(5)蒸馏需要蒸馏烧瓶、冷凝管、酒精灯、温度计、牛角管和锥形瓶等;达到提纯溴的目的,操作中应控制的关键条件是把温度控制在溴的沸点59°C,并收集该温度下的馏分,步骤⑤中,用图2所示装置进行蒸馏,收集液溴,装置图中缺少的必要仪是温度计和水浴,
故答案为:温度计;水浴;
(6)根据题给信息,溴和碳酸钠反应生成了溴化钠和溴酸钠,据此写出反应方程式为:Br2+Na2CO3→NaBr+NaBrO3,根据化合价升降总数相等配平为:3Br2+3Na2CO3→5NaBr+NaBrO3,根据原子守恒,还有产物二氧化碳3mol,故反应方程式为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,
故答案为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑;
(7)采用C装置,步骤少,减少了二氧化硫的污染,
故答案为:操作简单,污染小.
点评 本题结合海水提取溴的过程,考查了实验基本操作、实验方案的评价、氧化还原反应方程式的书写,在配平时抓住化合价升降总数相等,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 常温常压下,22.4L氢气的物质的量为1mol | |
| B. | 标准状况下,11.2L水的物质的量为0.5mol | |
| C. | 标准状况下,32g硫的体积为22.4L | |
| D. | 常温常压下,22g二氧化碳的物质的量为0.5mol |
| A. | 稀释溶液,水解平衡常数增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,pH增大 |
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性依次增强 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
 .
.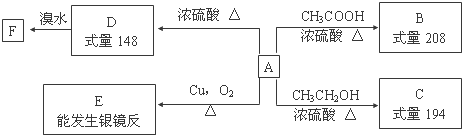
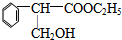 ,F的结构简式为
,F的结构简式为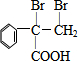 .
.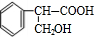 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$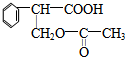 +H2O;②A→E:2
+H2O;②A→E:2 +2H2O.
+2H2O.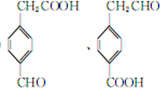 .
. 单质A、B、C与化合物甲、乙之间有如图所示的转化关系(部分产物已省略).
单质A、B、C与化合物甲、乙之间有如图所示的转化关系(部分产物已省略).