题目内容
下列关于pH=3的盐酸和醋酸溶液的说法正确的是( )
| A、两种溶液中由水电离出来的c(H+)不相同 |
| B、中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
| C、加入等质量的铁粉,反应过程中放出H2的速率相同 |
| D、分别用蒸馏水稀释m倍和n倍,两溶液pH仍相同,则m<n |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:氯化氢是强电解质,醋酸是弱电解质,存在电离平衡,pH相同的盐酸和醋酸,盐酸的浓度小于醋酸,加水稀释促进醋酸的电离,以此解答.
解答:
解:A.酸电离出氢离子抑制水的电离,pH=3的盐酸和醋酸溶液中氢离子浓度相同,对水的抑制程度相同,所以水电离出来的c(H+)相同,故A错误;
B.醋酸浓度大,则中和相同体积的两种酸溶液,则醋酸所需NaOH的物质的量较大,故B错误;
C.反应过程中醋酸进一步电离,醋酸溶液中氢离子浓度较大,反应速率较大,故C错误;
D.分别用蒸馏水稀释m倍和n倍,醋酸进一步电离,氢离子浓度较大,若稀释后两溶液pH仍相同,则醋酸中加水较多,则m<n,故D正确.
故选D.
B.醋酸浓度大,则中和相同体积的两种酸溶液,则醋酸所需NaOH的物质的量较大,故B错误;
C.反应过程中醋酸进一步电离,醋酸溶液中氢离子浓度较大,反应速率较大,故C错误;
D.分别用蒸馏水稀释m倍和n倍,醋酸进一步电离,氢离子浓度较大,若稀释后两溶液pH仍相同,则醋酸中加水较多,则m<n,故D正确.
故选D.
点评:本题考查了强酸弱酸的电离、溶液pH的变化分析、影响弱电解质电离平衡的因素,易错选项是C,注意生成氢气的速率与溶液中氢离子的浓度有关,题目难度不大.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
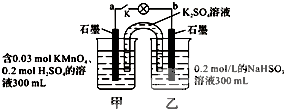

| A、当电路中有1.204×1022个电子转移时,乙烧杯中溶液的C(H+)约为0.1mol?L-1 |
| B、电池工作时,盐桥中的K+移向甲烧杯 |
| C、电池工作时,外电路的电子方向是从a到b |
| D、乙池中的氧化产物为SO42- |
气体A、B分别为0.6mol和0.5mol,在0.4L密闭容器中发生反应:3A+B?aC+2D,经5min后,此时C为0.2mol,又知在此反应时间内,D的平均反应速率为0.1mol?(L?min)-1,下列结论正确的是( )
| A、此时,反应混合物总的物质的量为1mol |
| B、B的转化率为50% |
| C、A的平均反应速率为0.1mol?(L?min)-1 |
| D、a值为2 |
在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、混合气体的分子数目 |
| D、混合气体的总物质的量 |
将10.2g的镁和铝投入1000ml 2mol/L的盐酸中,金属完全溶解,再加入4mol/L的NaOH溶液,若要使生成的沉淀最多,则应加入NaOH溶液的体积是( )
| A、100 ml |
| B、700 ml |
| C、600 ml |
| D、500 ml |
下列说法中错误的是( )
| A、石油只含碳、氢两种元素,是多种烃的混合物 |
| B、石油经分馏得到的各馏分仍是多种烃的混合物 |
| C、石油裂解的主要目的是获得不饱和烃 |
| D、裂化汽油里含有不饱和烃,不宜用作卤素的萃取剂 |

