题目内容
如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
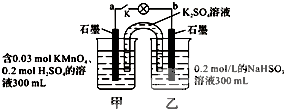

| A、当电路中有1.204×1022个电子转移时,乙烧杯中溶液的C(H+)约为0.1mol?L-1 |
| B、电池工作时,盐桥中的K+移向甲烧杯 |
| C、电池工作时,外电路的电子方向是从a到b |
| D、乙池中的氧化产物为SO42- |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:图中装置为原电池,反应中高锰酸钾被还原,在酸性条件下生成Mn2+,甲中电极为原电池的正极,乙中亚硫酸钠被氧化,为原电池的负极,被氧化生成SO42-,结合电极方程式解答该题.
解答:
解:A.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,则当电路中有1.204×1022个电子转移时,即0.02mol电子转移时,乙中生成0.03molH+,c(H+)=
=0.1mol/L,故A正确;
B.甲为正极,电池工作时,阳离子移向正极,盐桥中的K+移向甲烧杯,故B正确;
C.外电路的电子方向是从b(负极)到a(正极),故C错误;
D.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,氧化产物为SO42-,故D正确;
故选C.
| 0.03mol |
| 0.3L |
B.甲为正极,电池工作时,阳离子移向正极,盐桥中的K+移向甲烧杯,故B正确;
C.外电路的电子方向是从b(负极)到a(正极),故C错误;
D.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+,氧化产物为SO42-,故D正确;
故选C.
点评:本题综合考查原电池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握电极方程式的书写,为解答该题的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
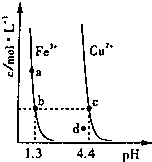 某温度下,Fe(OH)3(s)和Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图.线上任何一点表示的状态均为金属离子Mn+、OH-、M(OH)n(s)的平衡状态.据图分析,下列判断错误的是
某温度下,Fe(OH)3(s)和Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图.线上任何一点表示的状态均为金属离子Mn+、OH-、M(OH)n(s)的平衡状态.据图分析,下列判断错误的是( )
| A、Ksp[Fe(OH)3]>Ksp[Cu(OH)2] |
| B、c、d两点代表的溶液中c(H+) 与c(OH-)乘积相等 |
| C、d点所代表的Cu(OH)2溶液达到了饱和 |
| D、向含有相同浓度Fe3+和Cu2+的混合溶液中逐滴滴加NaOH溶液,先形成Fe(OH)3沉淀 |
下列叙述中正确的是( )
①锌跟稀硫酸制取氢气,加入少量硫酸铜溶液能加快反应速率
②镀层破坏后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③钢铁表面常易锈蚀生成 Fe2O3?H2O.
①锌跟稀硫酸制取氢气,加入少量硫酸铜溶液能加快反应速率
②镀层破坏后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③钢铁表面常易锈蚀生成 Fe2O3?H2O.
| A、都正确 | B、①③ | C、① | D、②③ |
下列关于pH=3的盐酸和醋酸溶液的说法正确的是( )
| A、两种溶液中由水电离出来的c(H+)不相同 |
| B、中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
| C、加入等质量的铁粉,反应过程中放出H2的速率相同 |
| D、分别用蒸馏水稀释m倍和n倍,两溶液pH仍相同,则m<n |
温度为T℃,压强为1.01×106Pa条件下,某密闭容器内,下列反应达到化学平衡A(g)+B(g)?3C,测得此时c(A)=0.022mol/L:压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得 c(A)=0.05mol/L;若继续压缩容器,使压强增大到4.04×106Pa,第三次达到平衡时,测得 c(A)=0.075mol/L.则下列关于C物质状态的推测正确的是( )
| A、C为非气态 |
| B、C为气态 |
| C、第二次达到平衡时C为气态 |
| D、第三次达到平衡时 C为气态 |
下列实验仪器不宜直接用来加热的是( )
| A、试管 | B、坩埚 | C、蒸发皿 | D、烧杯 |


