题目内容
回答下列问题:
(1)指出配合物K3[Co(CN)6]中的中心离子、配体和配位数: 、 、
(2)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”)
H3PO4 H3PO3; HClO4 H2SO4
(3)N2H4与H2O2反应:N2H4(l)+2H2O2=N2(g)+4H2O(g),H2O2的电子式为 ,N2H4的电子式为 ;N2H4分子中N原子的杂化方式 ,若该反应中有4mol N-H键断裂,则形成σ键有 mol和形成σ键有 mol.
(1)指出配合物K3[Co(CN)6]中的中心离子、配体和配位数:
(2)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”)
H3PO4
(3)N2H4与H2O2反应:N2H4(l)+2H2O2=N2(g)+4H2O(g),H2O2的电子式为
考点:原子轨道杂化方式及杂化类型判断,电子式,配合物的成键情况
专题:
分析:(1)根据配合物K3[Co(CN)6]结构分析中心离子为Co3+、配体为CN-、配位数为6;
(2)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强;
(3)N2H4分子中N原子电子对数为3+
=4,故N2H4分子中N原子的杂化方式为sp3;单键都是σ键,双键和三键中均只有一个σ键,其余的是π键.
(2)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强;
(3)N2H4分子中N原子电子对数为3+
| 5-1×3 |
| 2 |
解答:
解:(1)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+;CN-;6;
(2)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强,故酸性:H3PO4>H3PO3,HClO4>HClO3;
故答案为:>;>;
(3)H2O2的电子式为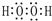 ;N2H4的电子式为
;N2H4的电子式为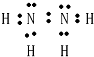 ;N2H4分子中N原子电子对数为3+
;N2H4分子中N原子电子对数为3+
=4,故N2H4分子中N原子的杂化方式为sp3;
反应N2H4(l)+2H2O2=N2(g)+4H2O(g)中,若该反应中有4mol N-H键断裂,则有1molN2H4参加反应,生成1molN2,4molH2O,则形成σ键有9mol和形成π键有2mol.
故答案为: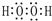 ;
;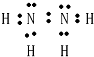 ;sp3;9;2.
;sp3;9;2.
故答案为:Co3+;CN-;6;
(2)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强,故酸性:H3PO4>H3PO3,HClO4>HClO3;
故答案为:>;>;
(3)H2O2的电子式为
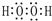 ;N2H4的电子式为
;N2H4的电子式为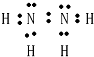 ;N2H4分子中N原子电子对数为3+
;N2H4分子中N原子电子对数为3+| 5-1×3 |
| 2 |
反应N2H4(l)+2H2O2=N2(g)+4H2O(g)中,若该反应中有4mol N-H键断裂,则有1molN2H4参加反应,生成1molN2,4molH2O,则形成σ键有9mol和形成π键有2mol.
故答案为:
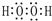 ;
;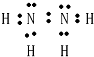 ;sp3;9;2.
;sp3;9;2.
点评:本题是对物质结构的考查,涉及配位键、元素周期律、价层电子对互斥理论等,难度不大,侧重对基础知识巩固.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、2 L 0.1 mol?L-1 K2SO4溶液中离子所带电荷总数约为0.6 NA |
| B、标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的原子总数均为2NA |
| C、1 mol Cl2变为Cl-时得到的电子数为NA |
| D、由质量守恒定律可知1mol的氯化铁能形成NA个氢氧化铁胶体粒子 |
下列叙述中正确的是( )
①锌跟稀硫酸制取氢气,加入少量硫酸铜溶液能加快反应速率
②镀层破坏后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③钢铁表面常易锈蚀生成 Fe2O3?H2O.
①锌跟稀硫酸制取氢气,加入少量硫酸铜溶液能加快反应速率
②镀层破坏后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③钢铁表面常易锈蚀生成 Fe2O3?H2O.
| A、都正确 | B、①③ | C、① | D、②③ |
若溶液中由水电离产生的c(OH-)=1×10-12 mol?L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A、Al3+ Na+ NO3- Cl- |
| B、K+ Na+ Cl- NO3- |
| C、K+ Na+ Cl- CO32- |
| D、K+ NH4+ SO42- NO3- |
下列关于pH=3的盐酸和醋酸溶液的说法正确的是( )
| A、两种溶液中由水电离出来的c(H+)不相同 |
| B、中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
| C、加入等质量的铁粉,反应过程中放出H2的速率相同 |
| D、分别用蒸馏水稀释m倍和n倍,两溶液pH仍相同,则m<n |
下列有关实验操作、现象描述和结论正确的是( )
| A、凡是能发生银镜反应的有机物都是醛 |
| B、所有卤代烃都是难溶于水,密度比水小的无色液体 |
| C、可用溴水作试剂除去苯中混有的少量苯酚 |
| D、苯酚有强腐蚀性,沾在皮肤上可用酒精洗涤 |
V mL硫酸铝溶液中含有mg SO42-,则Al3+的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|